


科目:高中化学 来源:不详 题型:单选题
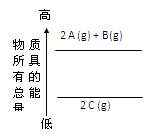
| A.2A(g)+ B(g)=2C(g);△H=a(a>0) | B.2A(g)+ B(g)=2C(g);△H=a(a<0) |
| C.2A + B="2" C;△H=a(a<0) | D.2C="2A" +B;△H=a(a>0) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.凡需加热的反应一定是吸热反应 |
| B.反应物的总能量比生成物的总能量小 |
| C.氢氧化钠与盐酸的反应属于吸热反应 |
| D.C02与CaO化合是放热反应,则CaC03分解是吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.反应过程中能量关系可用上图表示 |
| B.Zn和H2SO4的总能量大于ZnSO4和H2的总能量 |
| C.若将该反应设计成原电池,锌为负极 |
| D.若将其设计为原电池,当有32.5g锌溶解时,正极要放出11.2L气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
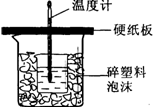
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CO2(g)+H2(g)
CO2(g)+H2(g) 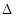 H=-41.16kJ/mol,对于该反应有关表述正确的是 。
H=-41.16kJ/mol,对于该反应有关表述正确的是 。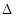 H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。
H 0(填“>”或“<”),从合成塔内出来的气体中仍含有一定量的CO2、NH3,应如何处理 。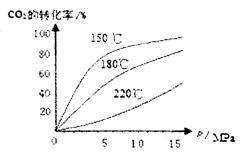
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.SO2通入Ba(NO3)2溶液中得到BaSO3沉淀 |
| B.中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,不影响测定结果 |
| C.凡放热反应都能自发进行,而吸热反应都非自发进行 |
| D.由C(石墨)=C(金刚石);△H=+1.90 kJ/mol可知金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在稀溶液中所有酸和碱反应的中和热数值都相等 |
| B.在稀溶液中1mol酸和1mol碱反应放出的热量都相等 |
| C.在稀溶液中HCl和NaOH反应的中和热与HNO3和KOH反应的中和热数值相等 |
| D.将浓硫酸滴入氢氧化钠溶液中刚好生成1mol水时,产生的热量即为中和热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com