
| A. | 1molCl2参加化学反应获得的电子数都是2NA | |
| B. | 6.4 gO2与O3的混合物中所含O原子数一定为0.4NA | |
| C. | 含4nmol HCl的浓盐酸与足量的MnO2加热反应,生成的Cl2分子数为nNA | |
| D. | 1mol某气体的体积为22.4L,该气体的状况一定是标准状况 |
分析 A、根据反应后氯元素的价态可能为-1价、+1价、+3价、+5价、+7价来分析;
B、氧气和臭氧均由氧原子构成;
C、二氧化锰只能与浓盐酸反应,与稀盐酸不反应;
D、标况下气体摩尔体积为22.4L/mol,但当是22.4L/mol时不一定为标况.
解答 解:A、根据反应后氯元素的价态可能为-1价、+1价、+3价、+5价、+7价,故1mol氯气不一定得到电子,还可能失电子,故A错误;
B、氧气和臭氧均由氧原子构成,故6.4g混合物中含有的氧原子的物质的量n=$\frac{6.4g}{16g/mol}$=0.4mol,个数为0.4NA个,故B正确;
C、二氧化锰只能与浓盐酸反应,与稀盐酸不反应,故盐酸不能完全反应,故生成的氯气分子个数小于NA个,故C错误;
D、标况下气体摩尔体积为22.4L/mol,但当是22.4L/mol时不一定为标况,故当1mol气体体积为22.4L时,不一定为标况,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用过滤的方法除去食盐中的泥沙 | |
| B. | 用渗析的方法除去淀粉中的氯离子 | |
| C. | 用结晶的方法分离氯化钠和硝酸钾 | |
| D. | 用分液的方法除去四氯化碳中混有的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾中铝离子水解产生的胶体具有很强的吸附作用而常用于净水 | |
| B. | 地球上99%以上的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| C. | 目前加碘盐中添加的含碘物质是KI,可用氯水和淀粉溶液鉴定食盐是否加碘 | |
| D. | 为减少污染、提高燃烧效率,可将煤气化或液化获得清洁燃料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
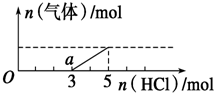 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | 常温下,a点溶液pH>7 | |
| C. | 标准状况下,通入CO2的体积为4.48L | |
| D. | 原NaOH溶液的物质的量浓度为2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol金属钠含有的电子数 | |
| B. | 1L 1mol/L硫酸溶液所含的H+数 | |
| C. | 标准状况下,22.4L四氯化碳所含的分子数 | |
| D. | 0.012kg12C所含的原子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -1528.6 kJ/mol | B. | -1639.8 kJ/mol | C. | -1473 kJ/mol | D. | -1695.4 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com