
分析 A.同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素;
B.同周期随原子序数增大,元素的电负性增大;
C.离子电荷越大、离子半径越小,晶格能越大,熔沸点越高;
D.二氧化硫为V形结构;
E.分子晶体中,分子间作用力越强,该分子晶体的熔沸点越高.
解答 解:A.同周期随原子序数增大,元素第一电离能呈增大趋势,P元素原子3p能级为半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能P>S>Si,故A错误;
B.同周期随原子序数增大,元素的电负性增大,故电负性C<N<O<F,故B正确;
C.离子电荷越大、离子半径越小,晶格能越大,熔沸点越高,晶格能CaO比KCl高,所以KCl比CaO熔点低
,故C正确;
D.二氧化硫与二氧化碳均为酸性氧化物,化学性质相似,二氧化碳分子为直线型结构,但二氧化硫为V形结构,故D错误;
E.分子晶体中,分子间作用力越强,该分子晶体的熔沸点越高,故E错误,
故选:BC.
点评 本题考查元素周期律、熔沸点高低比较,注意理解同周期元素第一电离能异常情况,掌握熔沸点高低比较规律.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | HCl分子的电子式H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{Cl}}{••}$${\;}_{•}^{•}$]- | |
| B. | 乙炔分子的结构式CH≡CH | |
| C. | H2O分子的比例模型 | |
| D. | 甲烷分子的球棍模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 压强 SO2转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
| 400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
| 500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
| 600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
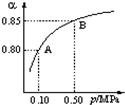 (4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.
(4)在一个固定容器为5L的密闭容器中充入0.20mol SO2(g)和0.10mol O2(g),t1时刻达到平衡,测得容器中含SO30.18mol.①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化,则改变的条件是C.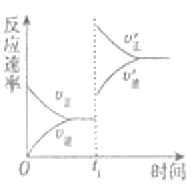
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 的沸点高.(填高或低)
的沸点高.(填高或低)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com