
【题目】已知:有机化合物A~F的相互转化关系如图,D为石油裂解的主要产物之一,D在标准状况下的密度为1.25 g·L-1,C能发生银镜反应,F为有香味的油状液体。

请回答:
(1)有机物B中含有的官能团名称是________________
(2)D→B的反应类型是______________________
(3)B+E→F的化学方程式是__________________________________________
(4)下列有关说法正确的是______________。
a.在加热条件下,有机物A和C都能使新制的碱性氢氧化铜悬浊液产生砖红色沉定。
b.F在碱性条件下加热水解属于取代反应,又叫皂化反应。
c.D和氧气在一定条件下反应也可以制得C或E。
d.有机物B中是否混有E可用金属钠进行检测。
【答案】 羟基 加成反应 CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O ac
CH3COOCH2CH3+H2O ac
【解析】淀粉水解生成葡萄糖,故A为葡萄糖,葡萄糖在酒化酶的作用下生成二氧化碳和乙醇,故B为乙醇,乙醇氧化生成乙醛,乙醛氧化生成乙酸,乙醇和乙酸发生酯化反应生成乙酸乙酯,故C为乙醛,E为乙酸,F为乙酸乙酯,D在标准状况下的密度为1.25 g·L-1,则D的摩尔质量为M(D)=1.25 g·L-1×22.4L/mol=28g/mol,再结合D与水反应生成乙醇,则D为乙烯。
⑴.有机物B是乙醇,含有的官能团是羟基,故答案是:羟基;
⑵.D是乙烯,B是乙醇,乙烯和水发生加成反应生成乙醇,故答案是:加成反应;
⑶.B是乙醇,E是乙酸,二者发生酯化反应生成乙酸乙酯,反应方程式是:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O,故答案是:CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O,故答案是:CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O;
CH3COOCH2CH3+H2O;
⑷.a.A是葡萄糖,C是乙醛,二者分子中都含有醛基,能使新制的碱性氢氧化铜悬浊液产生砖红色沉定,故a正确;
b.皂化反应指的是油脂在碱性条件下水解生成高级脂肪酸钠和甘油,而F是乙酸乙酯,不是油脂,故b错误;
c. 乙烯直接氧化法得到乙醛,又称瓦克法,反应式为:CH2=CH2+1/2 O2![]() CH3CHO,乙烯也可以在控制条件的情况下氧化生成乙酸,反应式为:CH2=CH2+ O2
CH3CHO,乙烯也可以在控制条件的情况下氧化生成乙酸,反应式为:CH2=CH2+ O2![]() CH3COOH,故c正确;
CH3COOH,故c正确;
d. B是乙醇,可以和金属钠反应生成氢气,E是乙酸,也可以和金属钠反应生成氢气,二者反应现象相同,故乙醇中是否混有乙酸不能用金属钠进行检测,故d错误;
故答案选ac。


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】大气中SO2和Nox是形成酸雨的主要物质,危害环境.
(1)某研究小组为了探究参与的硫酸型酸雨的形成,在烧瓶中充入含有少量NO的SO2气体,慢慢通入O2 , 该过程中发生的化学反应有、; 再喷射适量蒸馏水即可得硫酸型酸雨,其中NO的作用是 .
(2)减少SO2的污染并变废为宝是一项很重要的研究工作.我国正在探索在一定条件下用CO还原SO2得到单质硫得方法来除去SO2 , 该反应的化学方程式为 .
(3)有人提出:用氨水将SO2转化为NH4HSO3 , 再氧化成(NH4)2SO4来脱除烟气中的SO2 , 原因是(用离子方程式表示)
(4)为防止污染,将NO、NO2完全转化为最高价含氧酸盐,消耗1L2.4mol/LnaOH溶液和1molO2 , 则两种气体的物质的量分别为、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3 , 还含有Fe2O3、SiO2)提取氧化铝,冶炼铝的原料,提取的操作过程如图:
请回答下列问题:
(1)写出步骤①中发生反应的离子方程式;滤渣①的成分为 .
(2)写出步骤②中生成含铝化合物的化学方程式;能否将此步骤中的NaOH 溶液更换为氨水?(填“能”或“不能”).若不能,请说明理由:(若能,则此空不答).
(3)步骤③中的X 为(填化学式),发生反应的离子方程式为 .
(4)若铝土矿的质量为mkg,最后得到A12O3的质量为nkg(忽略提取过程中铝元素的损失),则铝土矿中铝元素的质量分数为(用含m、n 的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射嫦娥三号的长征三号乙运载火箭,其中第3级火箭中的能源物质为液态H2和液态O2,发生的反应为2H2(g)+O2(g)===2H2O(g)。下列说法不正确的是( )

A. 化合反应都是放热反应
B. 2 mol气态H2与1 mol气态O2的总能量大于2 mol水蒸气的总能量
C. 断裂2 mol H—H键、1 mol O—O键吸收的总能量小于形成4 mol H—O键释放的总能量
D. 氢气燃烧过程中能量变化可用如图表示:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,在一固定容积的密闭容器中发生反应:A(g)+B(g)![]() C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是
C(s)△H<0,按照不同配比充入A、B,达到平衡时容器中A、B浓度变化如图中曲线(实线)所示,下列判断正确的是

A. T℃时,该反应的平衡常数值为4
B. c点没有达到平衡,此时反应向逆向进行
C. 若c点为平衡点,则此时容器内的温度高于T℃
D. T℃时,直线cd上的点均为平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途。用镍(Ni)、铁作电极电解浓NaOH将收制备高铁酸盐Na2FeO4的装置如图所示。下列推断合理的是

A. 镍是阳极,电极反应为4OH--4e-=O2↑+2H2O
B. 电解时电流的方向为:负极→Ni电极→溶液→Fe→电极→正极
C. 若隔膜为阴离子交换膜,则OH-自右向左移动
D. 电解时阳极区pH降低、阴极区pH升高(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X,Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( ) 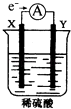
A.X极上发生的是还原反应
B.若两电极分别为Fe和碳棒,则Y为Fe
C.若反应进行一段时间后,产生2克H2时转移了1mol电子
D.溶液中的SO42﹣向X极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要配制2.0mol/L的NaOH溶液950ml,配制时应选用的容量瓶的规格和称取NaOH的质量分别是
A. 950ml,76.0g B. 500ml,,80g
C. 1000ml,76.0g D. 1000ml,80.0g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com