
| A. | 0.5 mol/L | B. | 0.45 mol/L | C. | 0.6 mol/L | D. | 0.55 mol/L |
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 全部由非金属元素组成的化合物一定是共价化合物 | |
| B. | 含有共价键的化合物不一定是共价化合物 | |
| C. | 由共价键形成的分子一定是共价化合物 | |
| D. | 硫酸分子中有H+和SO42-两种离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
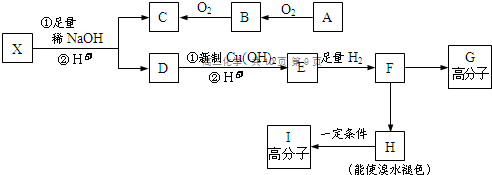
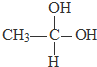 →CH3-CHO+H2O
→CH3-CHO+H2O ;
;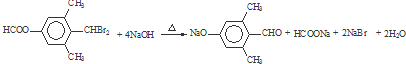 ;
;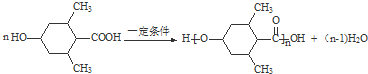 ;
;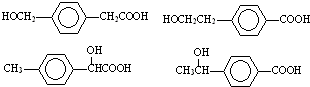 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁和稀HNO3反应后的溶液pH=1:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| B. | 碳酸氢镁溶液中加入过量澄清石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| C. | 0.01 mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+Al(OH)3↓+NH3•H2O | |
| D. | 碳酸氢钠溶液与过量的澄清石灰水反应:2HCO3-+Ca2++2OH-═CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O+H2O?H3O++OH- | B. | CO32-+H2O?HCO3-+OH- | ||
| C. | CO2+H2O?H2CO3 | D. | HCO3-+H2O?CO32-+H3+O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | |||||||
| 2 | ① | ② | ③ | ||||
| 3 | ④ | ⑤ | ⑥ | ||||
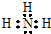 ,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.
,元素③和⑤对应的氢化物较稳定的是H2O(写化学式,下同),元素②和⑥对应最高价氧化物的水化物酸性较强的是HClO4.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某同学设计的放热反应的观察装置,其实验操作步骤如下①按图所示将实验装置连接好;②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.
如图是某同学设计的放热反应的观察装置,其实验操作步骤如下①按图所示将实验装置连接好;②在U形管内加入少量红墨水(或品红溶液),打开T形管活塞,使U形管内两边的液面处于同一水平面,再关闭T形管活塞;③在盛有1g氧化钙的小试管里滴入2mL左右的蒸馏水,观察现象.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com