
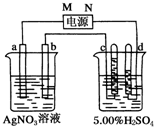
 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.分析 根据题意知,电极a、b上没有气体生成,则活性电极Ag作阳极,即a作阳极,b为阴极,所以M为正极,N为负极,c是阳极,d是阴极;
(1)根据以上分析确定M的电极;
(2)电解池阴极上析出银,根据转移电子数计算生成银的质量;
(3)根据生成物与转移电子的关系式计算;
(4)在铂电极上镀银时,阳极上的电极反应式为Ag-e-=Ag+,阴极上的电极反应式为Ag++e-=Ag,据此确定溶液中PH是否变化;
(5)分析可知电解过程中是电解水,依据溶质不变列式计算.
解答 解:(1)根据题意知,电极a、b上没有气体生成,则活性电极Ag作阳极,即a作阳极,b为阴极,所以M为正极,故答案为:正;
(2)电解稀硫酸反应时,当通电一段时间后,c、d两极共收集到336mL气体(标准状况),则阴极发生2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,实际上电解的是水,电池反应式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑,根据方程式知,生成氢气的体积占总体积的$\frac{2}{3}$所以混合气体中氢气的体积是224mL,根据2H++2e-═H2↑知,转移电子的物质的量是0.02mol,串联电解池中转移电子数相等,电镀池阴极上析出银的质量为
Ag++e-=Ag
1mol 108g
0.02mol 2.16g
故答案为:Ag;2.16g;
(3)b电极上的电极反应式为:Ag++e-=Ag
C.电极上的电极反应式为:4OH--4e-=2H2O+O2↑
d.电极上的电极反应式为:2H++2e-=H2↑
假设转移电子的物质的量是2mol,则生成银2mol、生成氧气0.5mol、生成氢气1mol,所以
所以电子的物质的量与电极b、c、d分别生成的物质的物质的量之比为:2:2:0.5:1,
故答案为:2;0.5;1;
(4)在铂电极上镀银时,阳极上的电极反应式为Ag-e-=Ag+,阴极上的电极反应式为Ag++e-=Ag,电解稀硫酸溶液时,阴极发生2H++2e-═H2↑,导致稀硫酸的浓度减小,溶液的pH值增大;
故答案为:不变;增大;
(5)设原5.00%的H2SO4溶液为xg,电解消耗水0.01×18=0.18g,则:5.00%x=5.02%(x-0.18),解得:x=45.18g.
故答案为:45.18.
点评 本题以电解池原理为载体考查了物质的量的有关计算、原电池正负极的判断等知识点,明确发生的电极反应及电子守恒是解答本题的关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
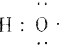 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同

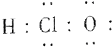
| A. | (1)(2)(4)(6) | B. | (2)(3)(5) | C. | (1)(4)(5) | D. | (1)(2)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1:验证苯中是否有碳碳双键 | |
| B. | 图2:验证NaHCO3和Na2CO3的热稳定性 | |
| C. | 图3:验证溴乙烷发生消去反应生成烯烃 | |
| D. | 图4:验证酸性CH3COOH>H2CO3>C6H5OH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金刚石 | B. | 氯化钠 | C. | 氢氧化钠 | D. | 碘 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
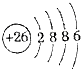
| A. | HCl电子式:H:Cl | B. | S原子结构示意图: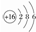 | ||
| C. | 10个中子的氧原子:${\;}_{8}^{18}$O | D. | CO2结构式:O═C═O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气和水反应:Cl2+H2O?2H++Cl-+ClO- | |
| B. | 碳酸钙与醋酸溶液反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 200 mL 2 mol/L的FeBr2溶液中通入11.2 L标准状况下的氯气:4Fe2++6Br-+5Cl2═4Fe3++3Br2+10Cl- | |
| D. | Na2S水解的离子方程式:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100 mL | B. | 45 mL | C. | 10 mL | D. | 15 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
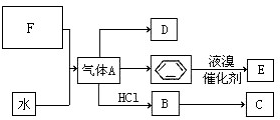 已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空:
已知:C是一种合成树脂,用于制备塑料和合成纤维,D是一种植物生长调节剂,用它可以催熟果实.根据以下化学反应框图填空: ;C的结构简式
;C的结构简式 ;
; +Br2 $\stackrel{FeBr_{3}}{→}$
+Br2 $\stackrel{FeBr_{3}}{→}$ +HBr,其反应类型为取代反应;
+HBr,其反应类型为取代反应; ,其反应类型为加聚反应.
,其反应类型为加聚反应.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com