
| A. | 一定有H2、CO2和HCl | B. | 一定有CO、CO2和水蒸气 | ||
| C. | 一定没有CO2,肯定有H2 | D. | 可能有CO2、NH3和水蒸气 |
分析 二氧化碳可使澄清石灰水变浑浊,但若有HCl的存在,澄清石灰水的溶质Ca(OH)2易与HCl反应,而使CO2难以与Ca(OH)2作用生成CaCO3沉淀;氢氧化钡溶液有浑浊现象又说明有二氧化碳;再根据酸碱的反应看HCl和NH3是否可以共存;最后根据氢气还原氧化铜生成水,二氧化碳一氧化碳还原氧化铜生成二氧化碳判断氢气和一氧化碳的存在.
解答 解:二氧化碳可使澄清石灰水变浑浊,但若有HCl的存在,澄清石灰水的溶质Ca(OH)2易与HCl反应,而使CO2难以与Ca(OH)2作用生成CaCO3沉淀,故①澄清石灰水(无浑浊现象)不能说明无CO2;②氢氧化钡溶液(有浑浊现象),说明含有CO2;①澄清石灰水(无浑浊现象),说明除了含有CO2外,还含有HCl,故一定不含有NH3;③浓H2SO4(无现象),吸收水分;④灼热氧化铜(变红),说明可能含有H2、CO;⑤无水硫酸铜(变蓝),生成了水,说明一定含有H2;故该混合气体一定含有H2、CO2和HCl,可能含有CO和水蒸气,一定不含有NH3,
故选A.
点评 本题考查学生根据氢氧化钡溶液与二氧化碳产生碳酸钡产生沉淀,气体有CO,H2能使氧化铜还原进行分析解题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
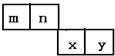 m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则:
m、n、x、y四种主族元素在周期表里的相对位置如图所示.已知它们的原子序数总和为46,则: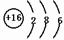 .
.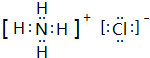 ,此物质在固态时属于离子晶体.
,此物质在固态时属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 向盐酸中加入浓硫酸 | 产生白雾 | 浓硫酸有吸水性 |
| B | 向某红色溶液中通入SO2气体 | 红色褪去 | SO2具有漂白性 |
| C | 将乙醇与浓硫酸共热产生的气体通入酸性高锰酸钾溶液中 | 紫红色变浅 | 反应生成乙烯 |
| D | 向碳酸钠溶液中滴加几滴酚酞后,加热 | 红色加深 | 盐类水解是吸热反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

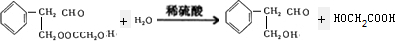
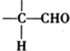 $\stackrel{稀氢氧化钠溶液}{→}$
$\stackrel{稀氢氧化钠溶液}{→}$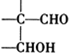 -CHO+
-CHO+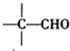 +NaOH(浓)→
+NaOH(浓)→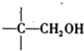 +
+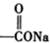
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlN可通过反应Al2O3+N2+3C$\frac{\underline{\;高温\;}}{\;}$2AlN+3CO合成.该反应中,每生成1 mol AlN需转移1.5 mol电子 | |
| B. | CsICl2是一种碱金属的多卤化物,这类物质在化学反应中既可表现氧化性又可表现还原性,则在CsICl2溶液中通入Cl2,有单质碘生成 | |
| C. | 反应A+3B═2C+2D在四种不同情况下的反应速率分别为①v(A)=0.15 mol/(L•s);②v(B)=0.6 mol/(L•s);③v(C)=0.4 mol/(L•s);④v(D)=0.45 mol/(L•s).该反应进行的快慢顺序为④>③=②>① | |
| D. | AlCl3溶液中加入过量稀氨水,则反应的离子方程式为:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
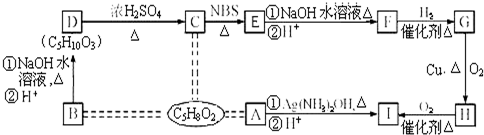
 ③
③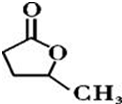 、
、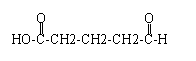 .
.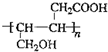 .
.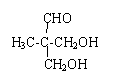 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H>0、△S>0的反应在任何温度下都不能自发进行 | |
| B. | 反应NH4HCO3(s)═NH3(g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据 | |
| D. | 在其它外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com