
分析 前四周期元素X、Y、Z、W、N核电荷数依次增加,Y 原子的M层p轨道有3个未成对电子,则外围电子排布为3s23p3,故Y为P元素;Z与Y同周期,且在该周期中电负性最大,则Z为Cl元素;W原子的L层电子数与最外层电子数之比为4:1,最外层电子数为2,其d轨道中的电子数与最外层电子数之比为5:2,d轨道数目为5,外围电子排布为3d54s2,故W为Mn元素,则X、Y、Z、W四种元素的核电荷数之和为58,则X核电荷数为58-15-17-25=1,故X为H元素;N3+的价电子排布式为3d5,则N的原子序数为2+8+8+5+3=26,故N为Fe,据此解答.
解答 解:前四周期元素X、Y、Z、W、N核电荷数依次增加,Y 原子的M层p轨道有3个未成对电子,则外围电子排布为3s23p3,故Y为P元素;Z与Y同周期,且在该周期中电负性最大,则Z为Cl元素;W原子的L层电子数与最外层电子数之比为4:1,最外层电子数为2,其d轨道中的电子数与最外层电子数之比为5:2,d轨道数目为5,外围电子排布为3d54s2,故W为Mn元素,则X、Y、Z、W四种元素的核电荷数之和为58,则X核电荷数为58-15-17-25=1,故X为H元素;N3+的价电子排布式为3d5,则N的原子序数为2+8+8+5+3=26,故N为Fe.
(1)由上述分析可知,W为Mn元素,N为Fe元素,在元素周期表中的位置:第四周期VIII族,
故答案为:Mn;第四周期VIII族;
(2)Y与X形成共价化合物A为PH3,Z与X形成共价化合物B为HCl,由于非金属性P<Cl,故氢化物还原性:PH3>HCl,故答案为:PH3;
(3)含W(Mn)元素的最高化合价的含氧酸根离子是MnO4-,MnO4-离子与FeSO4溶液反应的离子方程式:MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,
故答案为:MnO4-;MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O;
(4)W(Mn)的某黑色氧化物常于实验室制取Z单质,为二氧化锰与浓盐酸制备氯气,该反应的化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(5)元素N(Fe)的核电荷数是另一种元素Q的2倍,则Q为Al,则Al单质与烧碱溶液反应的化学方程式为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑.向反应后的溶液中,通入足量CO2,反应的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al+2NaOH+2H2O═2NaAlO2+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-.
点评 本题考查元素推断、核外电子排布、常用化学用语等,根据核外电子排布特点推断元素是解题关键,侧重对化学用语的考查,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.
某兴趣小组的同学用如图装置制取漂白液(有效成分为NaClO),并研究其相关性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |
| A.验证甲烷与氯气发生化学反应 | B.实验室制取乙酸乙酯 |
 |  |
| C.提取含杂质的粗苯甲酸 | D.提纯含杂质的工业酒精 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
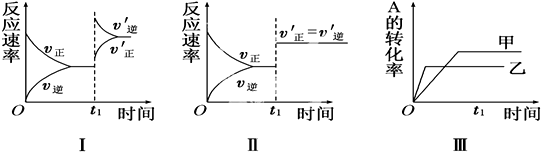
| A. | 图Ⅰ表示的是t1时刻升高温度对反应速率的影响 | |
| B. | 图Ⅱ表示的一定是t1时刻加入催化剂后对反应速率的影响 | |
| C. | 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 | |
| D. | 图Ⅲ表示的是温度对平衡的影响,且乙的温度比甲高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1种 | B. | 3种 | C. | 5种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
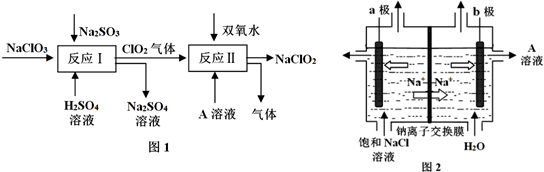
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
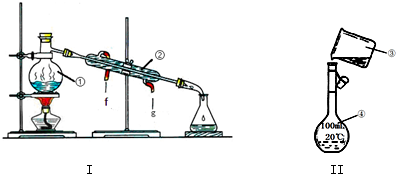
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,将相同的铝片分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | AgCl沉淀中滴加Na2S溶液可以得到Ag2S沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com