
���� ��1������Һ�м�������NaA���壬��Һ��c��A-����������HA���룻
��2��������Һ�м�������NaCl��Һ����ҺŨ�Ƚ��ͣ��ٽ�HA���룬��HA��������̶�С����Һ�������̶ȣ��¶Ȳ��䣬ˮ�����ӻ��������䣬����c��OH-��=$\frac{{K}_{w}}{c��{H}^{+}��}$�жϣ�
��3������Һ��c��H+��=0.1mol/L��0.1%=10-4 mol/L����Һ��pH=-lgc��H+����
��HA�ĵ���ƽ�ⳣ��K=$\frac{c��{H}^{+}����c��{A}^{-}��}{c��HA��}$����
�������¶ȴٽ�HA���룬������Һ��c��H+������
�ܸ���Һ��ˮ�������c��H+��=c��OH-����
��� �⣺��1������Һ�м�������NaA���壬��Һ��c��A-����������HA���룬��HA����ƽ�������ƶ���
�ʴ�Ϊ���棻c��A-������ƽ�����Сc��A-���ķ����淴Ӧ�����ƶ���
��2��������Һ�м�������NaCl��Һ����Һ�������HAŨ�Ƚ��ͣ��ٽ�HA���룬��HA��������̶�С����Һ�������̶ȣ�������Һ��c��A-����С���¶Ȳ��䣬ˮ�����ӻ��������䣬��Һ��c��H+����С����c��OH-��=$\frac{{K}_{w}}{c��{H}^{+}��}$����
�ʴ�Ϊ��������С������
��3������Һ��c��H+��=0.1mol/L��0.1%=10-4 mol/L����Һ��pH=-lgc��H+��=-lg10-4=4��
�ʴ�Ϊ��4��
��HA�ĵ���ƽ�ⳣ��K=$\frac{c��{H}^{+}����c��{A}^{-}��}{c��HA��}$=$\frac{1{0}^{-4}��1{0}^{-4}}{0.1}$=1��10-7��
�ʴ�Ϊ��1��10-7����
�������¶ȴٽ�HA���룬����ƽ�ⳣ��������Һ��c��H+��������Һ��pH��С���ʴ�Ϊ������С��
�ܸ���Һ��ˮ�������c��H+��=c��OH-��=$\frac{1{0}^{-14}}{1{0}^{-4}}$mol/L=10-10mol/L����HA�������c��H+��ԼΪˮ�������c��H+��106�����ʴ�Ϊ��106��
���� ���⿼��������ʵĵ��룬Ϊ��Ƶ���㣬��ȷ������ʵ����ص㡢Ӱ��������ʵ��������ǽⱾ��ؼ������ؿ���ѧ�������жϼ������������ѵ��Ǽ�������ˮ�������c��H+������Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ��ѧ��Ӧ�������ӷ���ʽ | �� �� |
| A | ����ڵ�����ˮ�еμӱ��͵��Ȼ�����Һ��Һ���Ϊ���ɫ��Fe3++3H2O=Fe��OH��3��+3H+ | �� ȷ |
| B | ����ʯ���ڴ���ķ�Ӧ��CaCO3+2H+=Ca2++CO2��+H2O | ������ӦдΪ������ʽCH3COOH��CaCO3Ӧд��������ʽ |
| C | ����ϡ���ᷴӦ��2Fe+6H+=2Fe3++3H2�� | �����ﲻ���Ͽ���ʵ |
| D | NaOH��Һ��ͨ������CO2��Ӧ��OH-+CO2=HCO3- | �� ȷ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 Ϊ�˼���úȼ�նԴ�����ɵ���Ⱦ��ú��������Һ���Ǹ�Ч���������ú̿����Ҫ;����������CO2������ŷ�Ҳ���������ٵ��ش���⣮
Ϊ�˼���úȼ�նԴ�����ɵ���Ⱦ��ú��������Һ���Ǹ�Ч���������ú̿����Ҫ;����������CO2������ŷ�Ҳ���������ٵ��ش���⣮�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ���ữѧʽ | HSCN | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.3��10-1 | 1.8��10-5 | 4.9��10-10 | K1=4.3��10-7����K2=5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na��O | B�� | Na+��O2- | C�� | Mg��Na | D�� | ?����2+��Na+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ?
? ��g��+H2��g����H=+124kJ•mol-1
��g��+H2��g����H=+124kJ•mol-1| ��ѧ�� | C-H | C-C | C=C | H-H |
| ����/kJ•mol-1 | 412 | 348 | x | 436 |
 +Cl2��g��?
+Cl2��g��? +HCl��g����H2��0
+HCl��g����H2��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
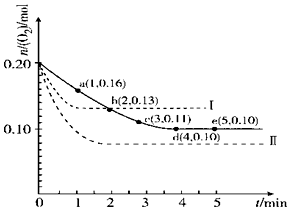 һ���¶��£���2L���ܱ������г���0.4mol SO2��0.2mol O2��������Ӧ��2SO2��g��+O2��g��?2SO3��g����H��0��n��O2����ʱ��ı仯��ϵ��ͼʵ����ʾ��
һ���¶��£���2L���ܱ������г���0.4mol SO2��0.2mol O2��������Ӧ��2SO2��g��+O2��g��?2SO3��g����H��0��n��O2����ʱ��ı仯��ϵ��ͼʵ����ʾ���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com