

分析 乙烯与水发生加成反应生成C为CH3CH2OH,乙烯与氢气发生加成反应生成A为CH3CH3,乙烯与氯气发生加成反应生成B为ClCH2CH2Cl,乙烷与氯气发生取代反应可以得到ClCH2CH2Cl,乙烯发生加聚反应生成高聚物为 ,以此解答该题.
,以此解答该题.
解答 解:乙烯与氯气发生加成反应生成B为ClCH2CH2Cl,乙烷与氯气发生取代反应可以得到ClCH2CH2Cl,则反应②的反应方程式为CH3CH3+2Cl2$\stackrel{光照}{→}$ClCH2CH2Cl+2HCl,反应⑤的反应方程式为CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH,
故答案为:CH3CH3+2Cl2$\stackrel{光照}{→}$ClCH2CH2Cl+2HCl;CH2=CH2+H2O$\stackrel{一定条件}{→}$CH3CH2OH.
点评 本题考查有机物的推断,为高考常见题型,侧重考查学生的分析能力,题目难度不大,注意把握常见有机物的性质和用途,特别是有机物官能团的结构和性质,在学习中注意积累相关知识.


科目:高中化学 来源: 题型:选择题
| A. | LiOH、KOH、CsOH的碱性依次增强 | B. | H2O、NH3、PH3的热稳定性依次增强 | ||
| C. | HCl、HBr、HI的还原性依次减弱 | D. | Na、Mg、Al的原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解熔融的氧化铝制取金属铝用铁作阳极 | |
| B. | 明矾水解时产生具有吸附性的胶体粒子,可作漂白剂 | |
| C. | 在镀件上镀铜时可用金属铜作阴极 | |
| D. | 除去MgCl2溶液中的CuCl2既可用MgO也可用Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究NOX和CO等的处理方法对环境保护有重要意义.
研究NOX和CO等的处理方法对环境保护有重要意义. ①计算0~4分钟在A催化剂作用下,反应速率v(NH3)=0.25mol/(L•min).
①计算0~4分钟在A催化剂作用下,反应速率v(NH3)=0.25mol/(L•min).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
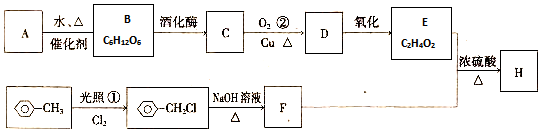
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )
已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )| A. | 正反应吸热,m+n>x+y | B. | 正反应吸热,m+n<x+y | ||
| C. | 正反应放热,m+n<x+y | D. | 正反应放热,m+n<x+y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | HCO3- | C. | OH- | D. | Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com