
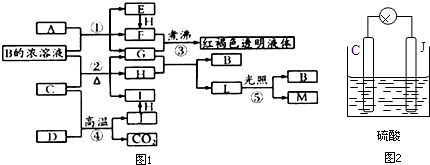
分析 H是元素气体非金属单质,则H为Cl2,J是一种金属单质,其同族的某种元素是形成化合物种类最多的元素,推断J为Pb,由J+H=I,可判断I为PbCl2,A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,则C为PbO2.结合C+D=J+CO2,应是碳和PbO2的反应,故D为C;
由F+G煮沸得到红褐色液体,证明生成的是氢氧化铁胶体,而E+H=F,A+B=E+F+G,可推断E为FeCl2,F为FeCl3,G为H2O,B为HCl,A为Fe3O4;根据G+H=B+L,可知L为HClO,则M为O2;B与C反应时,每生成1molH同时消耗4molB和1molC,发生反应:PbO2+4HCl=2H2O+Cl2↑+PbCl2,据此解答.
解答 解:H是元素气体非金属单质,则H为Cl2,J是一种金属单质,其同族的某种元素是形成化合物种类最多的元素,推断J为Pb,由J+H=I,可判断I为PbCl2,A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,则C为PbO2.结合C+D=J+CO2,应是碳和PbO2的反应,故D为C;
由F+G煮沸得到红褐色液体,证明生成的是氢氧化铁胶体,而E+H=F,A+B=E+F+G,可推断E为FeCl2,F为FeCl3,G为H2O,B为HCl,A为Fe3O4;根据G+H=B+L,可知L为HClO,则M为O2;B与C反应时,每生成1molH同时消耗4molB和1molC,发生反应:PbO2+4HCl=2H2O+Cl2↑+PbCl2.
(1)A物质的化学式为:Fe3O4,故答案为:Fe3O4;
(2)反应⑤是次氯酸见光分解的反应,化学方程式为:2HClO═2HCl+O2↑,
反应②是HCl与PbO2反应时,每生成1molCl2同时消耗4molHCl和1molPbO2,化学方程式为:PbO2+4HCl(浓)═PbCl2+Cl2↑+2H2O;
故答案为:2HClO═2HCl+O2↑;PbO2+4HCl(浓)═PbCl2+Cl2↑+2H2O;
(3)向氢氧化铁胶体中逐滴滴入HI溶液,开始电解质中和胶体胶粒所带电荷,发生胶体聚沉,得到氢氧化铁沉淀,而后HI与氢氧化铁发生酸碱中和反应、铁离子氧化碘离子生成碘,红褐色沉淀溶解的离子方程式为:2Fe(OH)3+2I-+6H+=I2+2Fe2++6H2O,
故答案为:2Fe(OH)3+2I-+6H+=I2+2Fe2++6H2O;
(4)由金属氧化物A为Fe3O4和C为PbO2 得到其相应的金属为Fe、Pb,依据金属活动顺序,在冶金工业上一般可用热还原法,其中从A得到其相应金属也可用铝热法,发生的反应为:3Fe3O4+8Al $\frac{\underline{\;高温\;}}{\;}$9Fe+4Al2O3,若反应中1molA参加反应,转移电子的物质的量为8mol,
故答案为:②;8mol;
(5)用PbO2、Pb作电极,与硫酸构成如图所示电池是铅蓄电池,正极为PbO2,电极反应为:PbO2+2e-+4H++SO42-═PbSO4+2H2O,负极为Pb,电极反应为:Pb+SO42--2e-=PbSO4,当反应转移1mol电子时,负极反应0.5molPb,其质量=0.5mol×207.2g/mol=103.6g,生成0.5molPbSO4,其质量=0.5mol×303.2g/mol=151.6g,故负极质量增加=151.6g-103.6g=48g,
故答案为:48.
点评 本题考查元素无机物推断,物质的颜色、J为电池的电极材料及同主族元素形成化合物最多等水推断突破口,再结合转化关系推断,需要学生熟练掌握元素化合物性质,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 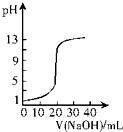 如图表示0.10 mol•L-1 NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 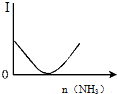 如图表示乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 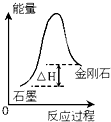 根据如图所示可知:石墨比金刚石稳定 | |
| D. | 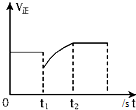 如图表示反应2SO2+O2?2SO3,t1时刻只减小了SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C两种元素可组成化学式为C2A4的化合物 | |
| B. | E氧化物的水化物有两性 | |
| C. | F与D形成的化合物性质很不活泼,不与任何酸反应 | |
| D. | 元素的非金属性由强到弱的顺序是D>C>F>B |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
.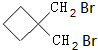 +CH2(COOC2H5)2+2C2H5ONa→
+CH2(COOC2H5)2+2C2H5ONa→ +2NaBr+2C2H5OH.
+2NaBr+2C2H5OH. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:7 | B. | 2:1 | C. | 2:7 | D. | 7:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com