
| A. | 金属锂作电池的负极 | |
| B. | 电池正极反应为FeS2+4Li++4e-═Fe+2Li2S | |
| C. | 放电时,Li+向负极迁移 | |
| D. | 电池总反应为FeS2+4Li═Fe+2Li2S |
分析 高容量锂电池,电极分别是二硫化亚铁和金属锂,电解液是含锂盐的有机溶剂,则Li为负极,失去电子发生氧化反应,二硫化亚铁为正极,得到电子发生还原反应,原电池中阳离子向正极移动,以此来解答.
解答 解:A.Li失去电子,作负极,故A正确;
B.二硫化亚铁为正极,得到电子发生还原反应,正极反应为FeS2+4Li++4e-═Fe+2Li2S,故B正确;
C.放电时,Li+向正极迁移,故C错误;
D.Li失去电子,Fe得到电子,电池总反应为FeS2+4Li═Fe+2Li2S,故D正确;
故选C.
点评 本题考查原电池,为高频考点,把握Li为负极及电极反应为解答本题的关键,侧重分析与应用能力的考查,注意原电池的工作原理及应用,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 沸点:NH3>H2O>H2S | |
| B. | 酸性:H2SO4>HClO4>H3PO3 | |
| C. | 结合质子的能力:CO32->ClO->CH3COO- | |
| D. | 气态氢化物的热稳定性:H2O>HF>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.6g | B. | 12g | C. | 6g | D. | 3.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
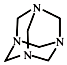
| A. | 化学式为C6H12N4,属于饱和烃 | |
| B. | 不能发生加成反应,一氯取代产物有3种 | |
| C. | 分子中既含极性共价键又含非极性共价键 | |
| D. | 可由甲醛(HCHO)与氨气按物质的量之比3:2完全反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
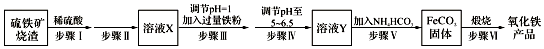
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
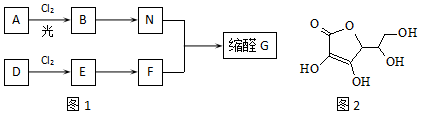
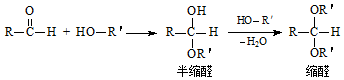
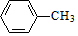 ,E的名称是1,2-二氯乙烷.
,E的名称是1,2-二氯乙烷.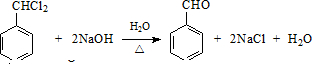 .
.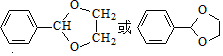 .G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式:
.G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式: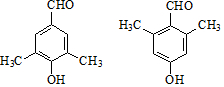 .
.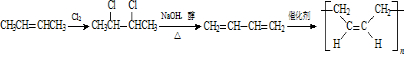 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
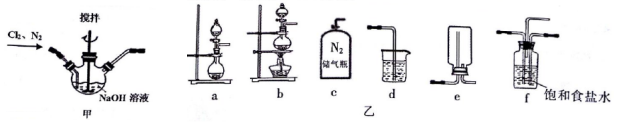
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
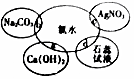 氯水具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(已知反应中氯水足量)
氯水具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空(已知反应中氯水足量)查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶液的pH:①>②>③ | |
| B. | 整个过程中Fe2(SO4)3溶液可以循环利用 | |
| C. | 溶液②转化为溶液③发生反应的离子方程式为4H++4Fe2++O2=4Fe3++2H2O | |
| D. | 向②溶液中滴加KSCN溶液,溶液可能变为血红色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com