

 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
| 1 |
| 2 |
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c��NH3��/��mol?L-1�� | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
 �������£��÷�Ӧ�ﵽ��ѧƽ��ʱ��������Ũ��Ϊ
�������£��÷�Ӧ�ﵽ��ѧƽ��ʱ��������Ũ��Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ģ�� ���ͣ������
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c��NH3��/�� mol?L��1�� | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |



�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011���㽭ʡ�����и߿���ѧģ���Ծ��������������棩 ���ͣ������
| ʱ��/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c��NH3��/ | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

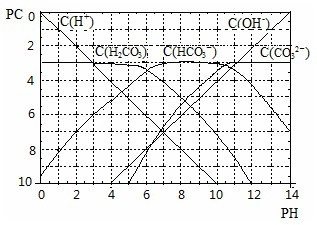
 H++HCO3�� �ĵ���ƽ�ⳣ�� ��
H++HCO3�� �ĵ���ƽ�ⳣ�� �� H++CO32���ƶ�����Һ��H+Ũ�ȱ仯������������Ϣ��ȷ����ˮ���Ȼ�淋Ļ����Һ�ܲ����γɻ�����Һ ��
H++CO32���ƶ�����Һ��H+Ũ�ȱ仯������������Ϣ��ȷ����ˮ���Ȼ�淋Ļ����Һ�ܲ����γɻ�����Һ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com