
�±�ΪԪ�����ڱ���һ���֣������Ԫ�آ١����ڱ��е�λ�ã�����ѧ�����ش��������⣺
|
| ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
| һ | �� | |||||||
| �� | �� | �� | �� | |||||
| �� | �� | �� | �� | �� | �� |
��1���ڱ��Ԫ���У�����õĽ���Ԫ���� ������õķǽ���Ԫ���� ��
��Ԫ�ص����ӽṹʾ��ͼ�� ��
��2��������γɹ��ۻ�����ĵ���ʽ ���õ���ʽ��ʾ������γɻ�������γɹ��� ��
��3���ݡ��ޡ�������Ԫ�ص�ԭ�Ӱ뾶�ɴ�С��˳���� ��
��4���ߡ��ࡢ��Ԫ�����γɵ���̬�⻯���У����ȶ����� ��
�ߡ��ࡢ������Ԫ�ص���ۺ������������ǿ������˳�� ��
��5��д����Ԫ�صĵ��������ᷴӦ�����ӷ���ʽ�� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
Ԫ�� ���ڱ������Ԫ�غͷǽ���Ԫ�طֽ��߸������ҵ�
���ڱ������Ԫ�غͷǽ���Ԫ�طֽ��߸������ҵ�
A����ũҩԪ�� B���ƴ���Ԫ��
C���ư뵼��Ԫ�� D�������ºϽ�Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
CaCl2�����ڶ�����·��ѩ��������ҵ�ķ����ȣ�ʵ���ҳ��������������ҵ�ϳ��ô���ʯ����������Al3+��Fe2+��Fe3+�����ʣ����Ʊ�����ͼΪʵ����ģ���乤�����̣�


��֪�������£���Һ�е�Fe3+��Al3+��Fe2+������������ʽ��ȫ������pH�ֱ�Ϊ��3.7��4��9.7��
��1����Ӧ���У��轫����ʯ���顢���裬ͬʱ�ʵ����ȣ���Ŀ���ǣ� �� ��
д����Ӧ������Ҫ��Ӧ�����ӷ���ʽ�� �� ��
��2������ʹ�������Ũ��Ϊ10%������37%��Ũ����������500mL�Ĵ���������IJ��������У�����������Ͳ���ձ�����ͷ�ιܡ� �� ��
��3����Ӧ���е����ӷ���ʽ�� �� ��
��4����Ӧ���б�����Ƽ���Ca(OH)2������ʹ��Һ��pHԼΪ8.0����ʱ����a�ijɷ�Ϊ��
�� ����pH��������ܷ�������Ӧ�����ӷ���ʽ�� �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������뾶��С�Ƚ���ȷ���ǣ�
A��Na����Mg2����Al3����O2�� B��S2����Cl����Na����Al3��
C��Na��Mg��Al��S D��Ca��Rb��K��Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��һ��2L�������У�����2mol����A,5���Ӻ����������A��ʣ��0.5mol���÷�Ӧ������A�Ļ�ѧ��Ӧ�����ǣ�
A��1.5mol/(L��min) B��0.15mol/(L��min)
C��0.75mol/(L��min) D��0.075mol/(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ�����ӵ�������������������ȷ����(����)
A��14 g��ϩ�ͱ�ϩ�Ļ��������ԭ����Ϊ3NA
B��������11.2 L�������庬�м��������Ϊ0.5NA
C��5.6 g����������ϡ���ᷴӦʧȥ������Ϊ0.3 NA
D��0.1 mol��L��1������������Һ�к���������Ϊ0.1NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�״�����Ϊȼ�ϵ�ص�ԭ�ϡ���CH4��H2OΪԭ�ϣ�ͨ�����з�Ӧ���Ʊ��״���
��CH4��g����H2O��g��=CO��g����3H2��g�� ��H��206.0 kJ��mol��1
��CO��g����2H2��g����CH3OH��g�� ��H����129.0 kJ��mol��1
��1��CH4��g����H2O��g����Ӧ����CH3OH��g����H2��g�����Ȼ�ѧ����ʽΪ____________________��
��2����1.0 mol CH4��2.0 mol H2O��g��ͨ���ݻ�Ϊ100 L�ķ�Ӧ�ң���һ�������·�����Ӧ�����һ����ѹǿ��CH4��ת�������¶ȵĹ�ϵ����ͼ��
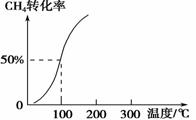 �ټ���100 ��ʱ�ﵽƽ�������ʱ��Ϊ5 min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ________��
�ټ���100 ��ʱ�ﵽƽ�������ʱ��Ϊ5 min������H2��ʾ�÷�Ӧ��ƽ����Ӧ����Ϊ________��
��100 ��ʱ��Ӧ���ƽ�ⳣ��Ϊ________��
��3����ѹǿΪ0.1 MPa���¶�Ϊ300 �������£���a mol CO��3a mol H2�Ļ�������ڴ��������·�����Ӧ�����ɼ״���ƽ����������ݻ�ѹ����ԭ����1/2�������������䣬��ƽ����ϵ������Ӱ����________������ĸ��ţ���
A��c��H2������
B������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
C��CH3OH �����ʵ�������
D������ƽ��c��H2��/c��CH3OH����С
E��ƽ�ⳣ��K����
(4) д���״���������KOH��Һ��ȼ�ϵ�ظ����ĵ缫��Ӧʽ��______________________��
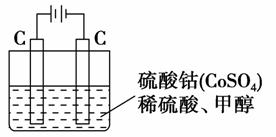 ��5���״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ��������������Ⱦ����ԭ���ǣ�ͨ���Co2��������Co3����Ȼ����Co3������������ˮ�еļ״�������CO2��������ʵ��������ͼװ��ģ���������̣�
��5���״���ˮ�ʻ����һ������Ⱦ����һ�ֵ绯ѧ��������������Ⱦ����ԭ���ǣ�ͨ���Co2��������Co3����Ȼ����Co3������������ˮ�еļ״�������CO2��������ʵ��������ͼװ��ģ���������̣�
��д�������缫��Ӧʽ________��
��д����ȥ�״������ӷ���ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�˵����ȷ����
A��25�� 101kPaʱ��CH4(g)+2O2(g)=CO2(g) +2H2O(g) ��H=��Q kJ/mol��
������ȼ����ΪQ kJ/mol
B��CaCO3(s)��CaO(s)+CO2(g) �����²����Է����У�˵���÷�Ӧ��
��H��0
C����ӦN2(g)��3H2(g) 2NH3��g����H��0�ﵽƽ��������¶ȣ���
2NH3��g����H��0�ﵽƽ��������¶ȣ���
Ӧ����v(H2)��H2��ƽ��ת���ʾ�����
D����֪�������������ֱ��������Ӧ���Ȼ�ѧ����ʽ���£�Q1��Q2��ֵ
�������㣩��
H2(g) +Cl2(g)��2HCl(g) ��H1����Q1 kJ/mol
H2(g) +Br2(g)��2HBr(g) ��H2����Q2 kJ/mol ���H1����H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��������˳������ȷ����
A�����ȶ��ԣ�HF��HCl��HBr B��ԭ�Ӱ뾶��Na��S��O
C�����Ӱ뾶�� Mg2+��O2-��F- D�����ԣ�HClO4��H2SO4��H3PO4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com