
| Li3N | NaNH2 | SiBr4 | Mg2Si |

分析 (1)CaC2+2H2O=Ca(OH)2+C2H2↑,该反应中各元素化合价不变,相当于发生复分解反应,据此分析;
(2)根据杂化理论这四种物质与水反应的产物中,氨气分子为三角锥型,溴化氢为直线型,硅烷为正四面体;
(3)根据杂化理论分析氨气分子的空间构型,H2NCl分子结构类似于NH3,据此书写电子式.
解答 解:(1)Li3N中N元素化合价为-3价,Li3N水解反应为:Li3N+3H2O=3LiOH+NH3↑,生成LiOH,
NaNH2中N元素化合价为-3价,Na元素化合价为+1价,NaNH2水解反应为:NaNH2+H2O=NaOH+NH3↑,生成NaOH,
SiBr4中Br元素化合价为-1价,Si元素化合价为+4价,SiBr4水解反应为:SiBr4+4H2O=H4SiO4+4HBr↑,生成H4SiO4,
Mg2Si中Si元素化合价为-4价,Mg元素化合价为+2价,Mg2Si水解反应为:Mg2Si+4H2O=2Mg(OH)2+SiH4↑,生成Mg(OH)2,
故答案为:LiOH、NaOH、H4SiO4、Mg(OH)2;
(2)NH3分子中的氮原子sp3杂化,有一个杂化轨道容纳弧对电子对,所以构型为三角锥,溴化氢为直线型,SiH4分子中碳原子sp3杂化,没有弧对电子对,所以构型为正四面体;
硅烷分子的结构式为 ,
,
故答案为: ;
;
(3)NH3分子中的氮原子sp3杂化,有一个杂化轨道容纳弧对电子对,所以构型为三角锥,H2NCl分子结构类似于NH3,所以H2NCl分子的空间构型为三角锥型,NH3属于共价化合物,分子中存在3对共用电子对,氮原子最外层为8个电子,氨气的电子式为 ,则H2NCl分子的电子式为$\underset{\stackrel{\;}{H:}}{\;}\underset{\stackrel{\underset{H}{••}}{N}}{••}\underset{\stackrel{\;}{:}}{\;}\underset{\stackrel{••}{Cl}}{••}\underset{\stackrel{\;}{:}}{\;}$
,则H2NCl分子的电子式为$\underset{\stackrel{\;}{H:}}{\;}\underset{\stackrel{\underset{H}{••}}{N}}{••}\underset{\stackrel{\;}{:}}{\;}\underset{\stackrel{••}{Cl}}{••}\underset{\stackrel{\;}{:}}{\;}$
故答案为:$\underset{\stackrel{\;}{H:}}{\;}\underset{\stackrel{\underset{H}{••}}{N}}{••}\underset{\stackrel{\;}{:}}{\;}\underset{\stackrel{••}{Cl}}{••}\underset{\stackrel{\;}{:}}{\;}$.
点评 本题以碳化钙制取乙炔为载体考查物质结构的有关知识,侧重考查学生知识迁移能力,明确碳化钙和水反应实质是解本题关键,注意杂化理论的熟练应用,题目难度中等.


科目:高中化学 来源: 题型:多选题
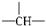 ,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )
,a个CH 3,其余为OH,则该物质分子中OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m+2-a |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
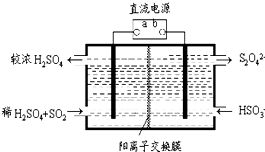 氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.
氮和硫的氧化物有多种,其中SO2和NOx都是大气污染物,对它们的研究有助于空气的净化.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 孤对电子对数 | 轨道杂化形式 | 分子或离子的空间构形 |
| SO3 | 0 | sp2杂化 | 平面三角形 |
| PO43- | 0 | sp3杂化 | 正四面体 |
| NCl3 | 1 | sp3杂化 | 三角锥形 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 向3-4mL 1mol/L AgNO3溶液中滴入1mol/L的Na2SO4溶液至反应完全. |
| 实验现象 | ①产生白色沉淀 |
| 离子方程式 | 2Ag++SO${\;}_{4}^{2-}$=Ag2SO4 |
| 小组讨论交流 | 取上述反应后的清液于试管中滴入适量1mol/L的NaCl 溶液,对于会出现的现象提出了假设 |
| 提出假设 | 假设Ⅰ:反应没有限度 假设Ⅱ:②无现象 |
| 证明假设Ⅱ | 现象③:产生白色沉淀;理由④反应存在限度,溶液中尚有较多Ag+ |
| 离子方程式 | ⑤Ag++Cl-=AgCl↓ |
| 解释 | ⑥加入Cl-产生了大量的白色沉淀,说明Ag++Cl- AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 AgCl↓反应是可逆反应,存在反应限度,所以Ag+不能反应完,才出现这种现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17 g NH3所含氢原子数目为3NA | |
| B. | 1L 1mol/L的盐酸溶液中,含氯化氢分子数为NA | |
| C. | 标准状况下,11.2L四氯化碳所含分子数为0.5 NA | |
| D. | 在同温同压时,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molS的质量是32g/mol | B. | 27g铝的物质的量为1 | ||
| C. | CO的摩尔质量为28g/mol | D. | 2H2O的摩尔质量为18g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com