
【题目】铁、钴、镍的性质非常相似,它们的化合物应用十分广泛。回答下列问题:
(1)基态铁原子的价电子排布式为__________。铁、钴、镍的基态原子核外未成对电子数最多的是________。
(2)CoCl2溶于氨水并通入空气,可从溶液中结晶出橙黄色的[Co(NH3)6]Cl3晶体。该配合物中中心离子是_________,配体分子的价层电子对互斥模型________。
(3)铁、镍易与CO作用形成羰基配合物Fe(CO)5、Ni(CO)4,Fe(CO)5的熔点为253K,沸点为376K,则Ni(CO)4固体属于晶体____________,1mol Ni(CO)4含有的配位键数目为_______。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78 pm,则熔点NiO__________FeO(填“>”“<”或“=”),原因是_____________。
(5)Fe3O4晶体中,O2-的重复排列方式如图所示,该排列方式中存在着由如1、3、6、7的O2-围成的正四面体空隙和3、6、7、8、9、12的O2-围成的正八面体空隙。Fe3O4中有一半的Fe3+填充在正四面体空隙中,另一半Fe3+和Fe2+填充在正八面体空隙中,则Fe3O4晶体中,正四面体空隙数与O2-数之比为___________,有___________%的正八面体空隙没有填充阳离子。Fe3O4晶胞中有8个图示结构单元,晶体密度为5.18g/cm3,则该晶胞参数a= _______________pm。(写出计算表达式)

【答案】 )3d64s2 铁(或Fe) Co3+ 四面体形 分子 8NA > 相同电荷的离子,半径越小,离子间的静电作用力越大,离子晶体的晶格能越大 2∶1 50% 
【解析】(1)本题考查价电子、电子排布式,Fe原子位于第四周期VIII族,其价电子包括最外层电子和次外层d能级,铁原子价电子排布式为3d64s2;铁原子、钴原子、镍原子属于同一族,且最外层s能级上都有2个电子,d能级有5个原子轨道,最多容纳10个电子,铁原子未成对电子数为4,钴原子未成对电子数为3,镍原子未成对电子数为2,因此未成对电子数最多的是Fe;(2)考查配位化合物,Co3+为配合物的中心离子,配体是NH3,中心原子为N,价层电子对数为3+(5-3)/2=4,因此价层电子对互斥模型为四面体;(3)本题考查晶体的判断、配位键,Ni(CO)4熔沸点较低,符合分子晶体的特点,因此Ni(CO)4属于分子晶体,Ni和CO之间存在配位键,配位数为4,则1molNi(CO)4中Ni和CO中存在4mol配位键,CO和N2互为等电子体,C和O之间存在叁键,即存在1个配位键,因此1molNi(CO)4中存在配位键的个数为8NA;(4)考查离子晶体熔沸点高低的判断,离子晶体熔沸点与晶格能有关,晶格能越大,熔沸点越高,晶格能与离子所带电荷数和离子半径有关,NiO和FeO中离子所带电荷数相等,但Ni2+的半径小于Fe2+的半径,因此NiO的晶格能比FeO大,即NiO的熔点高于FeO;(5)本题考查晶胞,根据信息,此结构中含有8个正四面体,O2-位于顶点和面心,个数为8×1/8+6×1/2=4,因此正四面体和O2-数之比为8:4=2:1;1、6、7、10能够成1/4的正八面体,即有12个1/4的正八面体,因此此结构中有4个正四面体,Fe3O4中有2个Fe3+和1个Fe2+,因此有两个正八面体没有被填充,即50%的正八面体空隙没有填充阳离子;一个这样的结构中有4个O2-,而Fe3O4晶胞中有8个图示结构单元组成,因此晶胞的质量为 g,晶胞的体积为(a×10-10)3cm3,代入密度的表达式,求出a=
g,晶胞的体积为(a×10-10)3cm3,代入密度的表达式,求出a= 。
。


科目:高中化学 来源: 题型:
【题目】已知:25℃、l0lkPa条件下
4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2834.9kJ/mol
4Al(s)+2O3(g)=2Al2O3(s) ΔH=-3119.91kJ/mol: 由此得出的结论正确的是
A. 等质量的O2比O3能量低,由O2变O3为吸热反应
B. 等质量的O2比O3能量低,由O2变O3为放热反应
C. O3比O2稳定,由O2变O3为吸热反应
D. O2比O3稳定,由O2变O3为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在浓硝酸中放入铜片:
(1)开始反应的化学方程式为 , 实验现象为 .
(2)若铜有剩余,则反应将要结束时的反应方程式为 .
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因是 .
(4)若将12.8g铜跟一定量的浓硝酸反应,铜消耗完时,共产生5.6L(标准状况)气体.则所消耗的HNO3的物质的量为 , 其中显氧化性的硝酸的物质的量为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示. 已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差l.下列说法正确的是( ) 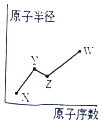
A.Y、Z、W处于同一周期
B.X、Y、Z、W的原子序数递增
C.X、W可形成化学式为XW的离子化合物
D.简单离子半径是Z大于W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料,如图是某化工厂对海水资源综合利用的示意图: 
试回答下列问题:
(1)实验室里将粗盐制成精盐的过程中,过滤的操作需用到玻璃棒,玻璃棒的作用是: , 还需要的玻璃仪器有: .
(2)粗盐中含有Ca2+、Mg2+、SO42﹣等杂质,精制后可得NaCl饱和溶液,精制时通常在溶液中:①加入过量的BaC12溶液,②过量的NaOH溶液,③过量的Na2CO3溶液,则添加试剂顺序为(填写序号),最后在滤液加入盐酸至溶液呈中性.请写出加入盐酸后可能发生反应的离子方程式: .
(3)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子.从离子反应的角度考虑,在母液里加入石灰乳发生反应的离子方程式: .
(4)电解无水氯化镁制取镁的化学方程式为 . 将镁蒸气冷却后即为固体镁,镁蒸气需在Ar气氛围中冷却,理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲除去甲烷气体中混有的乙烯得到纯净的甲烷,最好依次通过盛有( )试剂的装置.
A.澄清石灰水、浓H2SO4
B.酸性KMnO4溶液、浓H2SO4
C.溴水、浓H2SO4
D.CCl4、碱石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗痫灵(G)具有抗癫痫、抗惊厥、抗抑郁等功效,其合成路线如下图所示(某些反应条件和副产物已略):

(1)A中含氧官能团名称是__________;简述证明A含有该官能团的实验方法:_________。
(2)若以醛基为母体,则B的系统命名法的名称为_________;①~⑥的反应中属于加成反应的是 ___________ (填序号)。
(3)芳香化合物H是C的同分异构体,H的相关信息如下:a.可发生银镜反应; b.可与NaHCO3溶液反应生成气体;c.苯环上的一溴代物有2种,则H的结构简式为_______________。
(4)写出反应⑥的化学反应方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期三种元素X、Y、Z,原子序数依次递增,它们的最高价氧化物的水化物皆为强酸,下列说法不正确的是( )
A. Y 在自然界中存在游离态 B. 最高正价:X > Y > Z
C. Y 气态氢化物溶于水呈酸性 D. 非金属性:Y < Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用碱式碳酸铜[CuCO3·Cu(OH)2]制取铜粉并测定铜粉纯度的实验如下:
步骤1:将一定量的碱式碳酸铜置于烧杯中,向烧杯中加入N2H4的水溶液,边搅拌边加热,有大量的气体生成和红色铜析出,将沉淀过滤、低温干燥得红色粉末。
步骤2:称取1.9600 g红色粉末于烧杯中,缓慢加入足量稀硫酸,边加热边通入氧气使粉末完全溶解。冷却,将溶液移入100 mL 容量瓶中,用水稀释至刻度。
书骤3:准确量取20.00mL的溶液,调节溶液呈弱酸性,向其中加入过量的KI.,充分反应后,以淀粉溶液作指示剂,用0.2000mol/LNa2S2O3标准溶液滴定,滴定终点时共消耗Na2S2O3标准溶液30.00 mL.过程中所发生的反应如下:Cu2++I-![]() CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
CuI↓+I3-(未配平),I3-+S2O32-=S4O62-+I-(未配平)。
(1)步骤1中所发生反应的化学方程式为_________________。
(2)步骤2 中所发生反应的离子方程式为_________________。
(3)步骤3 中加入过量KI的作用是_________________。
(4)若铜粉中杂质不参与步骤3 的反应,通过计算确定红色粉末中含铜质量分数(写出计算过程)________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com