
【题目】下列图示不能说明某反应(或某可逆反应的正反应)一定是放热反应的是( )
A.  B.
B.  C.
C.  D.
D. 
科目:高中化学 来源: 题型:
【题目】在某温度时,将nmol/L氨水滴入10mL1.0mol/L盐酸中,溶液pH和温度随加入氨水体积变化曲线如图所示,下列有关说法正确的是( )

A. a点Kw=1.0×10-14
B. 水的电离程度:b>c>a>d
C. b点:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D. 25℃时,NH4Cl水解常数为(n-1)×10-7(用n表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
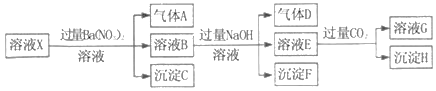
A. 溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣
B. 根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣
C. 沉淀H为Al(OH)3、BaCO3的混合物
D. 若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06molL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g) △H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
2SO3(g) △H<0,400℃时体积相同的甲、乙、丙三个容器中,甲容器绝热恒容,充入2molSO2和1molO2,乙容器恒温恒容,充入2molSO3,丙容器恒温恒压,充入2molSO3,充分反应达到平衡,下列说法正确的是
A. 甲和乙中反应的化学平衡常数相同
B. 乙和丙中的二氧化硫的生成速率相同
C. 乙中SO2的体积分数大于丙
D. 转化率:α甲(SO2)+α乙(SO3)<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有1 mL浓硫酸的试管中加人5 mL 0 .1 mol/L的K2 Cr2 O7溶液 | 溶液橙 色变深 | 增大生成物浓度,平衡Cr2 O |
B | 向Mg(OH)2悬浊液中加人少量醋酸铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg2++2NH3·H2O |
C | 相同温度下,同时向①4mL0.1 mol/L. KMnO4),酸性溶液和②4 mL 0.2 mol/LKMnO4,酸性溶液中,分别加人4mL 1 mol/L. H2 C2 O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于几种化学元素与植物代谢关系的叙述中,正确的是 ( )
A. O是组成糖类的基本元素之一,在有氧呼吸中CO2中的O来自丙酮酸
B. Fe是叶绿素的组成元素之一,没有Fe植物就不能进行光合作用
C. C是构成有机物的基本元素之一,可以在类囊体上通过光合作用形成有机物
D. P是构成ATP的必需元素之一,光合作用中只有光反应过程有ATP的合成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一恒容密闭容器中充入一定量的NO和炭粉,使之发生反应:C(s)+2NO(g)![]() CO2(g)+N2(g)ΔH,平衡时c(NO)与温度T的关系如图所示。下列说法正确的是
CO2(g)+N2(g)ΔH,平衡时c(NO)与温度T的关系如图所示。下列说法正确的是

A. ΔH>0
B. T2℃时,D点达到平衡时的平衡常数与B点的相等
C. 正反应速率:v(B)>v(D)>v(A)
D. 温度由T1升高到T3,NO的转化率增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com