
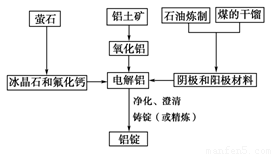
据新华社报道,发展改革委员会于2007年4月发出“遏制铝冶炼投资反弹”的紧急通知。原因是铝冶炼属高耗能产业,而且某些铝冶炼企业以污染环境为代价,得不偿失。
如图是传统的工业生产金属铝的基本流程图,阅读上述新闻信息,结合铝生产的流程图解答下列问题:
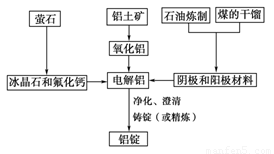
请回答:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品____________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是__________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:__________________________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?原因是:
________________________________________________________________。
(1)Al2O3(2分); 石墨(或碳)(2分)
(2)加入冰晶石(Na3AlF6)和少量CaF2 (2分)
(3)2C+O2 2CO (3分)
2CO (3分)
(4)MgCl2(熔融) Mg + Cl2↑(3分)
Mg + Cl2↑(3分)
熔点太高,MgCl2熔点低,熔化时能发生电离而导电;AlCl3是共价化合物,熔化时不能发生电离(3分)
【解析】
试题分析:(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是Al2O3;石油炼制和煤的干馏产品中石墨(或碳)可以导电,作电解铝的阴极和阳极材料;(2)氧化铝熔点高达2050 ℃,工业上为了降低能量消耗,由流程图知,在金属铝的冶炼中采取的措施是加入冰晶石(Na3AlF6)和少量CaF2 ;(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:2C+O2 2CO
;(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为MgCl2(熔融)
2CO
;(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为MgCl2(熔融) Mg + Cl2↑,镁和铝都是活泼金属,在电解冶炼过程中,一个用氯化物,一个用氧化物的原因是:氧化镁熔点太高,MgCl2熔点低,熔化时能发生电离而导电;AlCl3是共价化合物,熔化时不能发生电离。
Mg + Cl2↑,镁和铝都是活泼金属,在电解冶炼过程中,一个用氯化物,一个用氧化物的原因是:氧化镁熔点太高,MgCl2熔点低,熔化时能发生电离而导电;AlCl3是共价化合物,熔化时不能发生电离。
考点:考查化学与技术,涉及铝土矿冶炼铝及金属镁的冶炼。


科目:高中化学 来源:山东省莱芜一中2011届高三上学期期末复习诊断性测试(二)化学试题 题型:022
据新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设.可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的汽化和液化可以提高燃料的利用率.
已知25℃,101kPa时:C(s)+1/2O2(g)=CO(g) ΔH=-126.4 kJ·mol-1
2H2(g)+O2(g)=2H2O(l)
ΔH=-571.6 kJ·mol-1 H2O(g)=H2O(l) ΔH=-44 kJ·mol-1则在
25℃,101 kPa时:C(s)+H2O(g)=CO(g)+H2(g) ΔH=________.(2)
高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)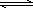 Fe(s)+CO2(g)
Fe(s)+CO2(g)
①
温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值________(填“增大”、“减小”或“不变”);②1100℃
时测得高炉中,c(CO2)=0.025 mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该平衡________移动(填“向左”、“向右”或“不”),判断依据是________(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
CO2(g)+3H2(g)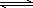 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
①从反应开始到平衡,氢气的平均反应速率v(H2)=________;
②下列措施能使![]() 增大的是________(填符号).
增大的是________(填符号).
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省宝鸡市金台区高三11月会考理综化学试试卷(解析版) 题型:填空题
据新华社报道,发展改革委员会于2007年4月发出“遏制铝冶炼投资反弹”的紧急通知。原因是铝冶炼属高耗能产业,而且某些铝冶炼企业以污染环境为代价,得不偿失。
如图是传统的工业生产金属铝的基本流程图,阅读上述新闻信息,结合铝生产的流程图解答下列问题:
请回答:
(1)工业冶炼金属铝用的是铝土矿,铝土矿的主要成分是________(填化学式)。石油炼制和煤的干馏产品____________(填物质名称)作电解铝的阴极和阳极材料。
(2)氧化铝熔点高达2050 ℃,工业上为了降低能量消耗,在金属铝的冶炼中采取的措施是__________________________。
(3)在冶炼过程中,阳极材料需要定期地进行更换,原因是该极材料不断被消耗,产生这种现象的原因是:__________________________________________(用化学方程式表示)。
(4)工业上制取金属镁时是电解MgCl2,电解反应方程式为_________________,镁和铝都是活泼金属,为什么在电解冶炼过程中,一个用氯化物,一个用氧化物?原因是:
_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
据新华社报道:全国农村应当在“绿色生态-美丽多彩-低碳节能-循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的汽化和液化可以提高燃料的利用率。
已知25℃,101kPa时:C(s) +1/2O2(g)=CO(g) ΔH= -126.4 kJ·mol-1
2H2(g) +O2(g)=2H2O(l) ΔH= -571.6 kJ·mol-1 H2O(g)= H2O(l) ΔH= -44 kJ·mol-1
则在25℃,101kPa时:C(s) + H2O(g)= CO(g) + H2(g) ΔH=____________________。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:
FeO(s)+CO(g) ![]() Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
Fe(s)+CO2(g) ΔH>0,已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值__________(填“增大”、“减小”或“不变”);
②1100℃时测得高炉中,c(CO2)=0.025mol·L-1,c(CO)=0.1 mol·L-1,则在这种情况下,该平衡_______移动(填“向左”、“向右”或“不”),判断依据是
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:
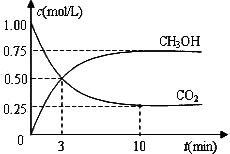
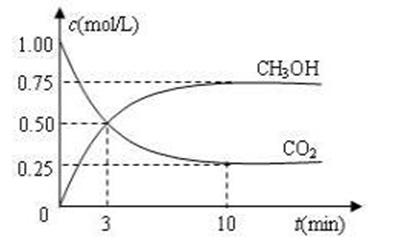
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ·mol-1。现向体积为1 L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。
|
 | ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
| ||||||||||||||
|
| |||||||||||||
| ||||||||||||||
①从反应开始到平衡,氢气的平均反应速率v(H2)=_____________;
②下列措施能使![]() 增大的是________(填符号)。
增大的是________(填符号)。
A.升高温度 B.再充入H2 C.再充入CO2
D.将H2O(g)从体系中分离 E.充入He(g),使体系压强增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com