
【题目】金属-空气电池是以金属为燃料,与空气中的氧气发生氧化还原反应产生电能的一种特殊燃料电池。如图为钠-空气电池的装置示意图,其中电解液为含NaPF6的有机电解液,可传导Na+.下列说法正确的是( )
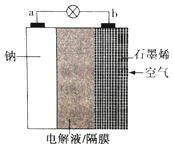
A.装置中电子转移途径:![]() 导线
导线![]() 电解液
电解液![]()
B.b电极为正极,发生还原反应
C.可用氯化钠水溶液代替该有机电解液
D.b电极的电极反应式:![]()
科目:高中化学 来源: 题型:
【题目】下列是某兴趣小组根据教材实验设计的一个能说明碳酸钠与碳酸氢钠热稳定性的套管实验。请观察如下图所示实验装置,分析实验原理,并判断下列说法和做法,其中不科学的是( )

A. 甲为小苏打,乙为纯碱
B. 要证明碳酸氢钠受热能产生水,可在小试管内塞上沾有无水硫酸铜粉末的棉花球
C. 加热不久就能看到A烧杯的澄清石灰水变浑浊
D. 整个实验过程中都没有发现A烧杯的澄清石灰水变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的各物质浓度数据如下:
aA(g)+bB(g)![]() 2C(g)
2C(g)
起始浓度(mol·L-1) 3.0 1.0 0
2 s末浓度(mol·L-1) 1.8 0.6 0.8
据此可推算出上述反应化学方程式中,各物质的化学计量数之比是( )
A. 9∶3∶4B. 3∶1∶2C. 2∶1∶3D. 3∶2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.浓硫酸具有强氧化性,不能干燥二氧化硫气体
B.相同条件下的![]() 和
和![]() 以1:1的体积比混合,在光照条件下充分反应,生成物中物质的量最多的为
以1:1的体积比混合,在光照条件下充分反应,生成物中物质的量最多的为![]()
C.由粗硅制高纯硅的过程中涉及:粗硅![]() 高纯硅,高纯硅可用来做光导纤维
高纯硅,高纯硅可用来做光导纤维
D.![]() 是引起酸雨的主要原因,燃煤中加入生石灰有利于减少
是引起酸雨的主要原因,燃煤中加入生石灰有利于减少![]() 的排放
的排放
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )

A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在密闭容器中发生反应:2CO(g)![]() C(s)+CO2(g)。
C(s)+CO2(g)。

①下列能说明该反应达到平衡的是___________。
A.CO和CO2的浓度之比为1∶1
B.CO和CO2的物质的量之比不再变化
C.混合气体的平均摩尔质量不再变化
D.形成amolC=O键的同时断裂amolC![]() O键
O键
②向某恒容容器中通入一定量的CO发生上述反应,在不同温度下CO2的物质的量浓度c(CO2)随温度的变化如上图所示,则该反应为________(填“放热”或“吸热”)反应。
③向容积可变的某恒压容器中通入amolCO,T℃时反应经过10min达平衡,CO的体积分数为75%。CO的平衡转化率为_______。在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示,则0-10min内平均反应速率v(CO2)=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图表示某反应的能量变化,对于该图的理解,你认为一定正确的是:

A. 曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化
B. 曲线Ⅱ可表示反应2KClO3![]() 2KCl+3O2↑的能量变化
2KCl+3O2↑的能量变化
C. 该反应不需要加热条件就一定能发生
D. 该反应的ΔH=E2-E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家最近发现一种只有六个中子构成的粒子,这种粒子称为“六中子”,也有人称之为“零号元素”。下列有关“六中子”粒子的说法不正确的是
A.该粒子不显电性B.该粒子质量数为6
C.在周期表中与氢元素占同一位置D.该粒子质量比氢原子的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为稀硫酸。放电时,该电池总反应式为:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
(1)该蓄电池的负极材料是_________,放电时发生_________(填“氧化”或“还原”)反应。
(2)该蓄电池放电时,电解质溶液的酸性_________(填“增大”、“减小”或“不变”),电解质溶液中阴离子移向_________(填“正”或“负”)极。
(3)已知硫酸铅为不溶于水的白色固体,生成时附着在电极上。试写出该电池放电时,正极的电极反应_______________________________________(用离子方程式表示)。
(4)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为H2SO4溶液,则氢氧燃料电池的正极反应式为__________________________________。该电池工作时,外电路每流过1×103 mol e-,消耗标况下氧气_________m3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com