
| A. | CH3CH2CH2-Cl | B. | 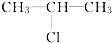 | C. | CH3CH2CH2-Br | D. | 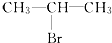 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题
 X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 工业上用电解MgCl2溶液的方法冶炼Mg | |
| B. | 钢铁发生吸氧腐蚀的正极反应式为4OH--4e-═O2↑+2H2O | |
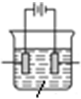
| C. | 如图中发生反应的方程式为:Fe+2H+=Fe2++H2↑ | |
| D. | 碱性锌锰干电池放电时的正极反应为:MnO2+H2O+e-=MnOOH+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚石和晶体硅 | B. | CO2和SiO2 | C. | KCl和HBr | D. | NaOH和NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
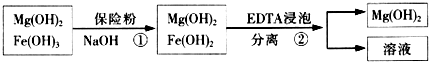
| 精制阻燃剂的条件 | 阻燃剂铁含量 | |||
| 序号 | 提纯体系温度/℃ | 加入EDTA质量/g | 加入保险粉质量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯分子的双键中有一个键较易断裂 | |
| B. | 乙烯分子里所有原子都在同一平面上,且碳氢键之间的键角为120° | |
| C. | 乙烯分子中2个碳原子都是sp2杂化,乙烯分子有5个σ键 | |
| D. | 乙烯和环丙烷(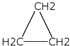 )的分子组成符合通式CnH2n,因此它们属于同系物 )的分子组成符合通式CnH2n,因此它们属于同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
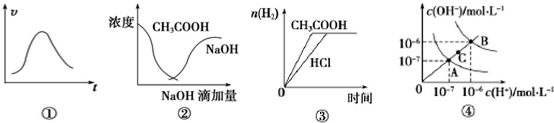
| A. | 图①可表示一定条件下,锌和稀硫酸反应的速率随时间变化的趋势图 | |
| B. | 图②中曲线表示将氢氧化钠溶液滴加到醋酸溶液中浓度的变化趋势图 | |
| C. | 图③表示等体积、等物质的量浓度的盐酸和醋酸,分别加足量镁粉,产生H2的物质的量变化 | |
| D. | 图④为水的电离平衡曲线图,若从A点到C点,可采用升高温度的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{c(C{H}_{3}COOH)}{c(O{H}^{-})}$ | B. | $\frac{c(O{H}^{-})}{c({H}^{+})}$ | C. | c(H+)和c(OH-)的乘积 | D. | OH-的物质的量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com