
【题目】资料显示:FeF3溶液接近无色。某同学据此进行以下实验,依据上述实验无法获得的结论是

A.FeF3是弱电解质
B.④中发生的离子反应为FeF3+3SCN-Fe(SCN)3+3F-
C.相同条件下,结合Fe3+的能力:SCN->F->OH-
D.向Fe(SCN)3溶液中加入NaF固体,溶液颜色会变浅
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】甲、乙均为1L的恒容密闭容器,向甲中充入1molCH4和1molCO2,乙中充入1molCH4和nmolCO2,在催化剂存在下发生反应:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是
2CO(g)+2H2(g),测得CH4的平衡转化率随温度的变化如图所示。下列说法正确的是
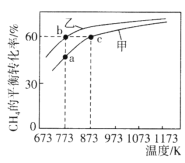
A.该反应的正反应是吸热反应
B.773K时,该反应的平衡常数小于12.96
C.H2的体积分数:![]()
D.873K时,向甲的平衡体系中再充入CO2、CH4各0.4mol,CO、H2各1.2mol,平衡不发生移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20 ℃时向20 mL 0.1 mol·L-1醋酸溶液中不断滴入0.1 mol·L-1 NaOH溶液,溶液pH变化如图所示。此过程中溶液中离子浓度的关系错误的是( )
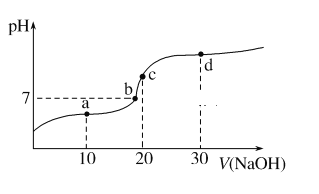
A. a点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B. b点:c(Na+)=c(CH3COO-)>c(H+)=c(OH-)
C. c点:c(H+)=c(CH3COO-)+c(OH-)
D. d点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保部门检测到某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,要求该工厂从该废水中回收硫酸亚铁和金属铜。该工厂设计了如下流程图,完成回收硫酸亚铁和铜的简单实验方案。
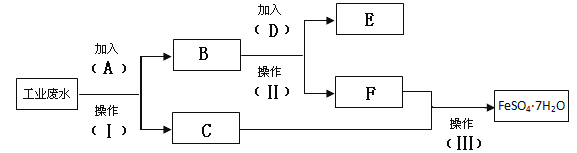
回答下列问题
(1)填写试剂A的化学式 _______________
(2)假如加入2mol D刚好完全反应,此步转移的电子的物质的量为 __________
(3)写出加入A的离子方程式: _________________
(4)操作Ⅱ和III 的名称分别是 ___________、 ____________、________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)写出下列物质在水溶液中的电离方程式
NaHSO4___________
(NH4)2CO3_______________
NaHCO3_____________________
(2)现有以下物质:①NaCl溶液 ②干冰 ③ 液态HCl ④铜 ⑤BaSO4固体 ⑥ 蔗糖⑦Na2O ⑧NaOH固体 ⑨盐酸 ⑩NH3
其中能够导电的是__(填序号,下同);属于电解质的是_______;属于非电解质的是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产和实验中广泛采用甲醛法测定饱和食盐水样品中的NH4+含量。利用的反应原理为:4NH4++6HCHO=(CH2)6N4H+(一元酸)+3H++6H2O。实验步骤如下:
①甲醛中常含有微量甲酸,应先除去。取甲醛amL于锥形瓶,加入1~2滴指示剂,用浓度为bmol/L的NaOH溶液滴定,滴定管的初始读数为V1mL,当锥形瓶内溶液呈微红色时,滴定管的读数为V2mL。
②向锥形瓶加入饱和食盐水试样cmL,静置1分钟。
③用上述滴定管中剩余的NaOH溶液继续滴定锥形瓶内溶液,至溶液呈微红色时,滴定管的读数为V3mL。
下列说法不正确的是
A.步骤①中的指示剂可以选用酚酞试液
B.步骤②中静置的目的是为了使NH4+和HCHO完全反应
C.步骤②若不静置会导致测定结果偏高
D.饱和食盐水中的c(NH4+)=![]() mol/L
mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含铬(Ⅵ)废水能诱发致癌,对人类和自然环境有严重的破坏作用。利用Cu2O光催化可以处理含有Cr2O72-的废水。
Ⅰ.制取Cu2O
(1)电解法:利用铜和钛做电极,电解含有NaCl和NaOH的溶液时,反应只消耗了铜和水,体系pH及Cl-浓度维持不变(溶液体积变化忽略不计)。阳极电极反应式是_______。
(2)还原法:控制100℃、pH=5的条件时,利用亚硫酸钠与硫酸铜溶液反应可以制得Cu2O,同时产生SO2气体。反应过程中需要不断地加入烧碱,其原因是_______。
Ⅱ.利用Cu2O光催化处理含Cr2O72-的废水的研究。
(1)光照射到Cu2O光催化剂上产生光催化反应,Cr2O72-和H2O分别在光催化反应中形成的微电极上发生电极反应,反应原理如图所示。写出Cr2O72-转化Cr3+的电极反应:_______。

(2)研究中对Cu2O的作用提出两种假设:
a.Cu2O作光催化剂;b.Cu2O与Cr2O72-发生氧化还原反应。
已知:Cu2O的添加量是2×10-4mol/L,Cr2O72-的初始浓度是1×10-3mol/L;对比实验(pH=3.0且其他条件相同),反应1.5小时结果如图所示。结合试剂用量数据和实验结果可得到的结论是_______,依据是_______。

(3)溶液的pH对Cr2O72-降解率的影响如图所示。

已知:Cu2O![]() Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
Cu+CuSO4;酸性越大,Cr2O72-被还原率越大。
①pH分别为2、3、4时,Cr2O72-的降解率最好的是___________,其原因是___________。
②已知pH=5时,会产生Cr(OH)3沉淀。pH=5时,Cr2O72-的降解率低的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
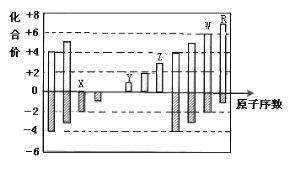
A.原子半径:Z>Y>X
B.气态氢化物的热稳定性:W>R
C.WX3和水反应生成的化合物是离子化合物
D.X元素在自然界中存在同素异形现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氧化锂(Li2O)晶体形成过程中的能量变化如图所示

下列说法正确的是
A. △H1< 0,△H2>0B. -△H5 +△H1 +△H1 +△H3+△H4 +△H6 =0
C. △H3<0,△H4 < 0D. △H1+ △H2+△H3 +△H4 =△H5+△H6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com