
【题目】I、烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下检测方法。回答下列问题:将vL气样通入适量酸化的H2O2溶液中,恰好使NOx完全被氧化成NO3-,加水稀释至100.00mL。量取20.00mL该溶液,加入v1mLc1mol·L-1FeSO4标准溶液(过量),充分反应后,用c2mol·L-1 K2Cr2O7标准溶液滴定剩余的Fe2+,终点时消耗v2mL。
(1)NO被H2O2氧化为NO3-的离子方程式为___。
(2)加水稀释到100.00ml所用的玻璃仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要___;滴定操作使用的玻璃仪器主要有___。
(3)滴定过程中发生下列反应:3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O、Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
则气样中NOx的物质的量为___mol。
(4)下列操作会使滴定结果偏高的是___
A.滴定管未用标准液润洗
B.锥形瓶洗净后还存留少量的水
C.滴定管滴定前读数正确,滴定后俯视读数
D.FeSO4标准溶液部分变质
II、常温下,用酚酞作指示剂,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1的 CH3COOH溶液和HCN溶液所得滴定曲线如图。

(已知:CH3COOH、 HCN的电离平衡常数分别为1.75×10-5、6.4×10-10)
(1)图___(a或b)是NaOH溶液滴定HCN溶液的pH变化的曲线。
(2)点③所示溶液中所含离子浓度的从大到小的顺序:___。
(3)点①和点②所示溶液中:c(CH3COO-)-c(CN-)___c(HCN)-c(CH3COOH)(填“>、<或=”)
【答案】2NO+3H2O2=2H++2NO3-+2H2O 100mL容量瓶 锥形瓶、酸式滴定管 ![]() CD a c(Na+)=c(CH3COO-)>c(H+)=c(OH-) =
CD a c(Na+)=c(CH3COO-)>c(H+)=c(OH-) =
【解析】
I、(1)NO被H2O2氧化为NO3-,N元素的化合价升高,过氧化氢中O元素的化合价降低;(2)加水稀释硝酸至100.00mL溶液时,需100mL容量瓶;滴定操作主要用到铁架台、酸式滴定管、锥形瓶等;(3)由反应结合电子守恒可知存在Cr2O72-~6Fe2+~2NO3-,以此计算;(4)误差分析的方法是把其他因素都归结到对标准溶液体积的影响上面来;
II、(1)由图象可知,V(NaOH)=0时,a曲线对应的酸的pH大于b曲线,则a曲线对应的酸的电离程度小于b曲线,结合CH3COOH、HCN的电离平衡常数大小分析解答:酸的电离平衡常数越大,酸的酸性越强,pH越小;(2)根据电荷关系判断;(3)混合溶液中存在物料守恒,点①、点②c(Na+)相同,根据物料守恒分析判断。
I、(1)NO被H2O2氧化为NO3-的离子方程式是2NO+3H2O2═2H++2NO3-+2H2O,故答案为:2NO+3H2O2═2H++2NO3-+2H2O;
(2)稀释硝酸至100.00mL溶液时,需100mL容量瓶,滴定操作主要用到铁架台、酸式滴定管、锥形瓶、其中玻璃仪器为酸式滴定管、锥形瓶,故答案为:100mL容量瓶;酸式滴定管、锥形瓶;
(3)n(Cr2O72-)=c2v2×10-3mol,由Cr2O72-~6Fe2+可知过量的Fe2+为6c2v2×10-3mol,则与量取的20.00mL溶液中NO3-反应的Fe2+为c1v1×10-3mol-6c2v2×10-3mol=(c1v1-6c2v2)×10-3mol,由3Fe2+~NO3-可知100.00mL原溶液中NO3-为![]() ×(c1v1-6c2v2)×10-3mol×
×(c1v1-6c2v2)×10-3mol×![]() =
=![]() ,故答案为:
,故答案为:![]()
(4)A、滴定管未用标准液润洗,导致消耗K2Cr2O7标准溶液体积增大,使测定剩余亚铁离子偏高,测定含N量偏低,则使NOx含量测定结果偏低,故A不选;
B、锥形瓶洗净后还存留少量的水,对整个测定结果无影响,故B不选;
C、滴定管滴定前读数正确,滴定后俯视读数,导致消耗K2Cr2O7标准溶液体积减小,使测定剩余亚铁离子偏低,由3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O中测定含N量偏高,则使NOx含量测定结果偏高,故C选;
D、FeSO4标准溶液部分变质,会导致测定剩余亚铁离子偏低,3Fe2++NO3-+4H+=NO↑+3Fe3++2H2O中测定含N量偏高,则使NOx含量测定结果偏高,故D选;故答案为:CD;
II、(1)由图象可知,V(NaOH)=0时,a曲线对应的酸的pH大于b曲线,则a曲线对应的酸的电离程度小于b曲线,由酸的电离平衡常数可知:酸的电离平衡常数越大,酸的酸性越强,pH越小,所以a曲线是NaOH溶液滴定HCN溶液的pH变化的曲线,故答案为:a;
(2)溶液的电荷关系为c(Na+)+c(H+)=c(CH3COO-)+c(OH-),点③所示溶液呈中性,c(H+)=c(OH-),所以溶液中所含离子浓度的从大到小的顺序为c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故答案为:c(Na+)=c(CH3COO-)>c(H+)=c(OH-);
(3)点①和点②溶液中物料守恒得c(CH3COO-)+c(CH3COOH)=c(CN-)+c(HCN)=2c(Na+),所以有c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH),故答案为:=;


科目:高中化学 来源: 题型:
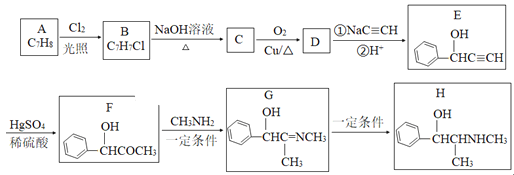
【题目】有机物H是一种中枢神经兴奋剂,其合成路线如图所示。
请回答下列题:
(1)A的化学名称为___,C的结构简式为___。
(2)E中官能团的名称为___。B→C、G→H的反应类型分别为___、__。
(3)D分子中最多有___个原子共平面。
(4)写出C→D反应的化学方程式为___。
(5)同时满足下列条件的E的同分异构体有___种(不考虑立体异构)。
①与E具有相同官能团;②苯环上有三个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请仔细观察下列几种物质的结构示意图,判断下列说法正确的是
A. 硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为
硼镁超导物质的晶体结构单元如图所示,则这种超导材料的化学式为![]()
B. 锂的某种氧化物晶胞如图所示,则该氧化物的化学式为
锂的某种氧化物晶胞如图所示,则该氧化物的化学式为![]()
C. 某晶体的一部分如图所示,则这种晶体中A、B、C三种粒子数之比是3:9:4
某晶体的一部分如图所示,则这种晶体中A、B、C三种粒子数之比是3:9:4
D. Mn和Bi形成的某种晶体的结构示意图如图所示
Mn和Bi形成的某种晶体的结构示意图如图所示![]() 白球均在六棱柱内
白球均在六棱柱内![]() ,则该晶体物质的化学式为
,则该晶体物质的化学式为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种新型的绿色能源,又是一种重要的化工原料。
①氢气燃烧热值高。实验测得,在常温常压下,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,则H2燃烧的热化学方程式正确的是________。
A.H2(g)+![]() O2(g)═H2O(g)△H=+285.8kJ/mol
O2(g)═H2O(g)△H=+285.8kJ/mol
B. H2(g)+![]() O2(g)═H2O(l)△H=﹣285.8kJ/mol
O2(g)═H2O(l)△H=﹣285.8kJ/mol
C. H2(g)+![]() O2(g)═H2O(l)△H=+285.8kJ/mol
O2(g)═H2O(l)△H=+285.8kJ/mol
D. H2+![]() O2═H2O△H=﹣285.8 kJ/mol
O2═H2O△H=﹣285.8 kJ/mol
②氢氧燃料电池能量转化率高,具有广阔的发展前景。氢氧燃料电池中,发生还原反应的物质是______(填“氢气”或“氧气”)。
③氢气是合成氨的重要原料,合成氨反应的热化方程式如下:
N2(g)+3H2(g)2NH3(g) △H=﹣92.4 kJ/mol
反应达到平衡后,升高温度则反应速率_______(填“增大”或“减小”);平衡将向____________(填“正反应方向”或“逆反应方向”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇可作为燃料电池的原料,以CH4和H2O为原料,通过下列反应来制备甲醇:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0kJmol-1
CO(g)+2H2(g)═CH3OH(g) △H=-129.0kJmol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为______。
(2)甲醇对水质会造成一定污染,有一种电化学法可消除这种污染,其原理是通电后,将Co2+氧化成Co3+,然后以Co3+作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置模拟上述过程:

①完成除去甲醇的离子方程式:______
Co3++CH3OH+H2O═Co2++……
②若如图装置中的电源为甲醇—空气—KOH溶液的燃料电池,则电池负极的电极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着国家大力发展清洁能源产业的要求,以太阳能为代表的新能源产业规模得以迅速地壮大。试完成下列问题。
(1)现在电瓶车所用电池一般为铅蓄电池,如图所示:
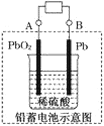
这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-![]() 2PbSO4+2H2O。则电池放电时,溶液的pH会________(填“增大”或“减小”),写出负极反应式为____________。充电时,铅蓄电池的负极应与充电器电源的________极相连。
2PbSO4+2H2O。则电池放电时,溶液的pH会________(填“增大”或“减小”),写出负极反应式为____________。充电时,铅蓄电池的负极应与充电器电源的________极相连。
(2)为体现节能减排的理念,中国研制出了新型燃料电池汽车,该车装有“绿色心脏”——质子交换膜燃料电池。如图是某种质子交换膜燃料电池原理示意图。该电池的正极是________(填“a”或“b”,下同)极,工作过程中,质子(H+)透过质子交换膜移动到________极。写出该电池的负极反应式为:__________。
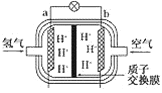
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,一定量的Na2C03与盐酸混合所得溶液中,部分含碳微粒的物质的量分数(![]() )与pH的关系如图所示。下列说法正确的是
)与pH的关系如图所示。下列说法正确的是

A. 曲线X表示的微粒为CO32-
B. pH=6.3时,![]() (CO32-)+
(CO32-)+![]() (HCO3-)+
(HCO3-)+![]() (H2CO3)=1.0
(H2CO3)=1.0
C. pH=7时,c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)=c(H+)
D. pH=10.3 时,c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列选项正确的是( )
A.25℃时,AgBr在0.0lmol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B.53℃时,将0.01mol/L的醋酸溶液加水不断稀释,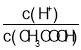 减小
减小
C.Na2CO3、NaHCO3溶液等浓度等体积混合后:3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸铵是一种重要的化工原料,通常用合成氨及合成硝酸的产物进行生产
(1)硝酸铵水溶液pH__________7(填“>”、“=”或“<”),其水溶液中各种离子浓度大小关系为___________
(2)已知合成氨的热化学方程式为:N2(g)+ 3H2(g)![]() 2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
2NH3(g)△H=-92kJ/mol,按照氮气和氢气的物质的量之比1:3的比例,分别在200℃、400℃、600℃的条件下进行反应,生成物NH3的物质的量分数随压强的变化曲线如图所示
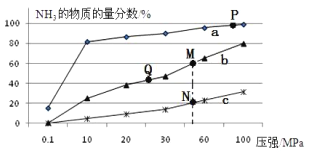
①曲线c对应的温度为___________ ℃
②下列说法中正确的是___________
A.增大氢气浓度,可促进平衡正向移动并能提高氮气的转化率
B.Q点对应的反应条件下,若加入适当的催化剂,可提高NH3在混合物中的物质的量分数
C.M、N两点的平衡常数大小关系为:M>N
D.M、N、Q三点反应速率的大小关系为:N>M>Q
E.为了尽可能多的得到NH3,应当选择P点对应的温度和压强作为生产条件
(3)尿素[CO(NH2)2]是一种非常重要的高效氮肥,工业上以NH3、CO2为原料生产尿素,该反应实际为两步反应:
第一步:2NH3(g)+CO2(g)=H2NCOONH4(s) ΔH=-272kJ·mol-1
第二步:H2NCOONH4(s)=CO(NH2)2(s)+H2O(g) ΔH=+138kJ·mol-1
写出工业上以NH3、CO2为原料合成尿素的热化学方程式:_________________________
(4)柴油汽车尾气净化器通常用尿素作为氮氧化物尾气的吸收剂,生成物均为无毒无污染的常见物质,请写出尿素与NO反应的化学方程式__________,当有1mol尿素完全反应时,转移电子的数目为___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com