
����Ŀ��25 ��ʱijЩ����ĵ���ƽ�ⳣ�����±���ʾ��
CH3COOH | HClO | H2CO3 |
K��CH3COOH�� ��1.8��10-5 | K��HClO�� ��3.0��10-8 | K��H2CO3��a1��4.4��10-7 K��H2CO3��a2��4.7��10-11 |
�����£�ϡ��CH3COOH��HClO������ʱ����Һ��pH���ˮ���仯��������ͼ��ʾ������˵����ȷ������ ��
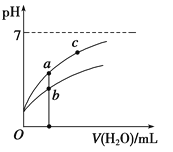
A����ͬŨ�ȵ�CH3COOH��HClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�
c��H+����c��ClO-����c��CH3COO-����c��OH-��
B��ͼ����a��c������������Һ��![]() �����HR����CH3COOH��HClO��
�����HR����CH3COOH��HClO��
C��ͼ����a�����Ũ�ȴ���b�����Ũ��
D����NaClO��Һ��ͨ������������̼�����ӷ���ʽΪ��2ClO����CO2��H2O��2HClO��CO32��
���𰸡�B
��������
���������A������ĵ��볣�����ڴ����ᣬ������ͬŨ�ȵ�CH3COOH��HClO�Ļ����Һ�У�������Ũ�ȵĴ�С��ϵ�ǣ�c��H+����c��CH3COO-����c��ClO-����c��OH-����A����B����![]() �ķ��ӡ���ĸͬʱ����������Ũ�ȿɵã�
�ķ��ӡ���ĸͬʱ����������Ũ�ȿɵã�![]() ���¶Ȳ��䣬��ñ�ֵ���䣬����ˮ�����ӻ��͵���ƽ�ⳣ��ֻ���¶�Ӱ�죬a��c���¶���ͬ����ñ�ֵ��ȣ�B��ȷ��C��pH��ȵ�CH3COOH��HClO��ϡ����ͬ�ı���ʱ����ǿ����������Ũ��С�ڽ����ᣬ��������pHС�ڽ�ǿ�ᣬ����CH3COOH��HClO������a�������߱�ʾCH3COOH��b�������߱�ʾHClO��������ĵ���̶�С�ڴ��ᣬ���Դ����Ũ�ȼ�С���������Ũ�Ƚϴ�a��b������ȣ�������ͬ�����ˮ����Ȼ�Ǵ������Ũ�Ƚϴ���ͼ����a�����Ũ��С��b�����Ũ�ȣ�C����D��̼��Ķ�������С�ڴ����ᣬ����̼��������ӵ�����С�ڴ����ᣬ����NaClO��Һ��ͨ������������̼�����ӷ���ʽ��ClO-+CO2+H2O�THClO+HCO3-��D������ѡB��
���¶Ȳ��䣬��ñ�ֵ���䣬����ˮ�����ӻ��͵���ƽ�ⳣ��ֻ���¶�Ӱ�죬a��c���¶���ͬ����ñ�ֵ��ȣ�B��ȷ��C��pH��ȵ�CH3COOH��HClO��ϡ����ͬ�ı���ʱ����ǿ����������Ũ��С�ڽ����ᣬ��������pHС�ڽ�ǿ�ᣬ����CH3COOH��HClO������a�������߱�ʾCH3COOH��b�������߱�ʾHClO��������ĵ���̶�С�ڴ��ᣬ���Դ����Ũ�ȼ�С���������Ũ�Ƚϴ�a��b������ȣ�������ͬ�����ˮ����Ȼ�Ǵ������Ũ�Ƚϴ���ͼ����a�����Ũ��С��b�����Ũ�ȣ�C����D��̼��Ķ�������С�ڴ����ᣬ����̼��������ӵ�����С�ڴ����ᣬ����NaClO��Һ��ͨ������������̼�����ӷ���ʽ��ClO-+CO2+H2O�THClO+HCO3-��D������ѡB��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A��Һ̬�Ȼ��⡢�����Ȼ��ؾ������磬��HCl��KCl��Ϊ�ǵ����
B��SO2��SO3ˮ��Һ���ܵ��磬�ʶ��߾�Ϊ�����
C��ͭ��ʯī���ܵ��磬�������Ƕ��ǵ����
D�����ǡ��Ҵ���ˮ��Һ�к�����״̬�¶������磬���������Ƿǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ��CuCl�����л��ϳɹ�ҵ�г�������������һ�ְ�ɫ���壬����ˮ���ױ������е�����������ij�о���ѧϰС������HCl�������ȷֽ�CuCl2��2H2O����ˮCuCl2���ټ����Ʊ�CuCl��������ͼ��ʾװ�ý������ʵ��̽�����г������ԣ���
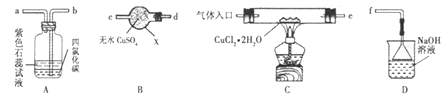
��ش��������⣺
��1������X��������_________��װ������˳���� ��_____��_____��_____��_____��f��
��2��ʵ��������Ⱥ�˳���Ǣ١�_____��_____��_____���ݣ�������ı�ţ���
�ټ��װ�õ������Ժ����ҩƷ ��Ϩ��ƾ��ƣ���ȴ ���ڡ�������ڡ���ͨ�����HCl
�ܵ�ȼ�ƾ��ƣ����� ��ֹͣͨ��HCl��Ȼ��ͨ��N2����ͨ��N2�����Ŀ����________��
��3����ʵ������У��۲쵽B�������ɰ�ɫ��Ϊ��ɫ��A���ϲ���Һ����ɫ�仯��______���²�CCl4�������Ǣ���������Cl2����________��
��4��װ��D�з�����������ԭ��Ӧ�����ӷ���ʽΪ________��
��5����Ӧ������ȡ��CuCl��Ʒ����ʵ�飬�������к���������CuO���ʣ��������ԭ��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£�
�ٽ���ʽ�ζ���������ˮϴ�����ô�����Һ��ϴ2��3�κ���ע�������Һ�����ڵζ��ܵļ��첿�ֳ�����Һ����ʹ��Һ�洦�ڡ�0���̶����µ�λ�ã����¶�����
�ڽ���ƿ������ˮϴ����ֱ�ӴӼ�ʽ�ζ����з���20.00mL������Һ����ƿ�У�
�۽���ʽ�ζ���������ˮϴ��������������ע��0.2000mol/L��ϡ������Һ�����ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦�ڡ�0���̶����µ�λ�ã����¶�����
�� ����ƿ�е��뼸�η�̪��ָʾ�������еζ��������������������
����ƿ�е��뼸�η�̪��ָʾ�������еζ��������������������
���ظ����Ϲ��̡�
�Իش��������⣺
��1�����������һ��ϡ����ʱ��____________________�����жϴﵽ�ζ��յ㡣
��2���ζ������У����лᵼ�µζ����ƫ�͵����� ��
A������¼����ʱ����ʼʱ���ӣ��յ�ʱ����
B���ζ�ǰ����ƿ�м���10 mL����ˮ�������������
C������������ʱ������ʱ���ӿ̶ȣ�������������
D����ʽ�ζ�����װ��Һǰδ�ô���������Һ��ϴ
E����ʼʵ��ʱ��ʽ�ζ��ܼ��첿�������ݣ��ζ�����������ʧ
��3���ⶨ��������һ���������⣬�ò����ǣ�__________________���������
��4�������������ݣ�
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 20.00 | 0.50 | 25.45 |
�ڶ��� | 20.00 | 4.00 | 29.05 |
������ | 20.00 | 3.00 | 30.00 |
���Ĵ� | 20.00 | 2.00 | 27.00 |
���������ռ���Һ��Ũ��Ϊ mol/L��
��5��Ϊ�˲ⶨ��Ʒ����NH4��2Cr2O7�ĺ�������ȡ��Ʒ0.150 0 g��������ƿ�У���50 mLˮ���ټ���2 g KI�����������Թ�����ϡ������Һ��ҡ�ȣ���������10 min������3 mL 0.5%������Һ��ϡ�ͳ�250ml��Һ��ȡ25ml����Һ����0.010 0 mol/L Na2S2O3����Һ�ζ����յ㣬����Na2S2O3����Һ30.00 mL����������Ʒ����NH4��2Cr2O7�Ĵ���Ϊ �����ٶ����ʲ��μӷ�Ӧ����֪����Cr2O72����6I����14H
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����NOx�Դ�������Ⱦ����ҵ��ͨ���������·�Ӧ��NOx��NH3=N2+ H2O����������������NO2��NO�Ļ������5 L��������ͬ״����6 LNH3ǡ��ʹ����ȫת����N2������������NO2��NO�����֮��Ϊ
A. 1��4 B. 2 �� 1 C. 3��1 D. 4��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�ص�����������Ӧ��ˮ���������ǿ���ǣ� ��
A. Al B. Si C. S D. Na
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��4�����ڵ����������Ԫ�ص����λ�������Ԫ��x��ԭ�Ӻ����������m��2����y��������������ԡ��ش��������⣺
m | n | ||
x | y |
��1��Ԫ��x�����ڱ��е�λ���ǵ�_____���ڡ���____�壬�䵥�ʿɲ��õ�����ڵ�_____�����Ʊ���
��2��m��n��y����Ԫ������������ˮ�����У�������ǿ����______��������ǿ����______.(�ѧʽ)
��3���������(mn)2�ĵ���ʽΪ_______��(mn)2��Ϊ��±�أ�������±�����ƣ���������������Һ��Ӧ�Ļ�ѧ����ʽ��_____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������X��ŨH2SO4���ȣ���Ӧ��X��ŨH2SO4�����ʵ���֮��Ϊ1:2����XԪ�����������еĻ��ϼۿ���Ϊ ����l ����2 ����3 ����4
A. �ڢ� B. �ۢ� C. �٢� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ȷ���ǣ� ��
A.2��������
B.2���һ�����
C.3��������
D.1��3��3����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com