
| A. | 2.8g铁与0.05mol Cl2充分反应,转移0.15NA电子 | |
| B. | 27g Al与足量NaOH溶液反应生成 33.6L H2 | |
| C. | 14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有原子的数目为3NA | |
| D. | 0.1mol Na2O2与足量二氧化碳反应转移0.2NA个电子 |
分析 A.2.8gFe的物质的量为0.05mol,0.05mol铁完全反应消耗0.15mol氯气,氯气不足,需要根据氯气的物质的量计算转移的电子数;
B.没有告诉在标准状况下,不能使用标准状况下的气体摩尔体积计算;
C.乙烯和丙烯的最简式为CH2,根据最简式计算出混合物中含有的原子数;
D.0.1mol过氧化钠与二氧化碳完全反应生成0.05mol氧气,过氧化钠中氧元素的化合价为-1价,据此计算出转移的电子数.
解答 解:A.2.8gFe的物质的量为:$\frac{2.8g}{56g/mol}$=0.05mol,0.05mol铁完全反应消耗0.15mol氯气,氯气不足,0.05mol Cl2充分反应转移了0.1mol电子,转移0.1NA电子,故A错误;
B.不是标准状况下,不能使用标准状况下的气体摩尔体积计算生成氢气的体积,故B错误;
C.14g由乙烯(C2H4)和丙烯(C3H6)组成的混合物中含有14g最简式CH2,含有最简式CH2的物质的量为1mol,1mol最简式CH2中含有3mol原子,含有原子的数目为3NA,故C正确;
D.0.1mol过氧化钠与二氧化碳完全反应生成氧气的物质的量为0.05mol,Na2O2中氧元素的化合价为-1价,则生成0.05mol氧气转移了0.1mol电子,转移l0.1NA个电子,故D错误;
故选C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系;B为易错点,注意没有告诉在标准状况下.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 以上各物质对应的计量数依次为1、6、14、3、2、7 | |
| B. | Cr2O72-发生了还原反应 | |
| C. | □处对应的物质是H2O | |
| D. | 若0.1mol Cr2O72-参加反应,产生氯气物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: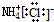 | |
| B. | 氯离子的结构示意图: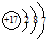 | |
| C. | 乙酸的结构简式:CH3COOH | |
| D. | 硫酸的电离方程式:H2SO4=H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
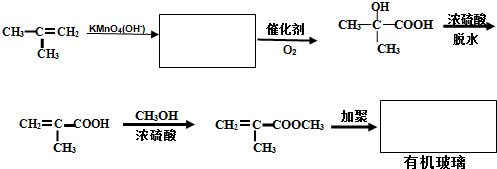
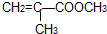 不溶于水,并可以发生以下变化:
不溶于水,并可以发生以下变化: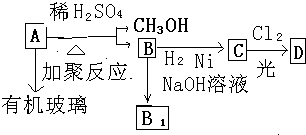
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com