
【题目】以苯甲醛为原料,通过Cannizzaro反应来制备苯甲醇和苯甲酸,反应式为:
主反应:
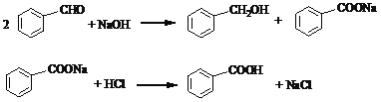
副反应:
![]()
主要物料的物理常数如下表:
名称 | 分子量 | 性状 | 相对密度 (g·cm-3) | 沸点 (℃) | 溶解度 | ||
水 | 乙醚 | ||||||
苯甲醛 | 106 | 无色液体 | 1.04 | 179 | 微溶 | 易溶 | |
苯甲酸 | 122 | 无色晶体 | 1.27 | 249 | 0.21g | 66g | |
苯甲醇 | 108 | 无色液体 | 1.04 | 205 | 微溶 | 易溶 | |
乙醚 | 74 | 无色液体。 | 0.71 | 35 | 不溶 | -- | |
实验步骤:
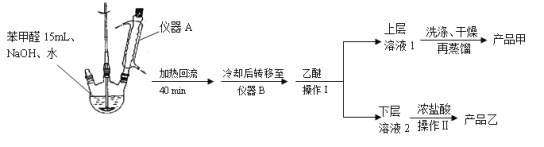
(1)仪器A的作用是_______________。
(2)蒸馏操作时温度应该控制在___________左右。获得产品乙时进行的操作Ⅱ的名称是__________________。
(3)①上层溶液1中除乙醚外主要有机杂质是____________、_____________。
洗涤时先后用到了饱和NaHSO3 溶液、10%的NaHCO3溶液和水。
②洗涤操作在______________中进行。
a.烧杯 b.布氏漏斗 c.烧瓶 d.分液漏斗
③加入10%的NaHCO3溶液至___________________(填现象)时说明杂质已被除尽。
(4)若产品甲的质量为5.40 g,则产品甲的产率是_____________________。
【答案】冷凝回流205℃抽滤(过滤、减压过滤)苯甲醛苯甲酸d无气泡生成67.9%
【解析】
由装置图并结合题中信息可知,苯甲醛与NaOH反应的生成物为苯甲醇、苯甲酸钠的混合物,然后加水、乙醚萃取苯甲醇,则乙醚溶液中含苯甲醇,操作I为蒸馏,得到产品甲为苯甲醇;水溶液中含苯甲酸钠,加盐酸反应生成苯甲酸,苯甲酸的溶解度小,则操作II为过滤,产品乙为苯甲酸。
(1).由仪器结构特征可知A为冷凝管,作用是冷凝回流,故答案为:冷凝回流;
(2).苯甲醛和氢氧化钠反应得到苯甲酸钠和苯甲醇,苯甲醇的沸点是205℃,所以蒸馏操作时温度应该控制在205℃左右,苯甲酸钠可以和盐酸反应得到苯甲酸,则产品乙为苯甲酸,获得产品乙时进行的操作Ⅱ的名称是抽滤(过滤、减压过滤),故答案为:205℃;抽滤(过滤、减压过滤);
(3).①.上层液中还含有未反应的苯甲醛、苯甲酸,苯甲酸、苯甲醛的沸点较低,易溶于有机物溶剂中,即上层溶液1中除乙醚外主要有机杂质是苯甲醛、苯甲酸,故答案为:苯甲醛、苯甲酸;
②. 上层溶液1中除乙醚外主要有机杂质是苯甲醛、苯甲酸,在蒸馏前需要除杂,由于乙醚不溶于水,因此洗涤操作需要在分液漏斗中进行,故答案为d;
③.饱和NaHSO3 溶液、10%的NaHCO3溶液分别为了除去苯甲醛和苯甲酸,因此当没有气泡生成时说明杂质已被除尽,故答案为:无气泡生成;
(4).苯甲醇的理论产量为:![]() ×108g=7.95g,则苯甲醇的产率为
×108g=7.95g,则苯甲醇的产率为![]() ×100%=67.9%,故答案为:67.9%。
×100%=67.9%,故答案为:67.9%。


科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:

下列说法中不正确的是:
A. Ⅰ种气体有无色变红棕色的化学方程式为:2NO+O2=2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 键角:BF3>CH4>H2O>NH3
B. CO2、HClO、HCHO分子中一定既有σ键又有π 键
C. 已知反应N2O4(l)+2N2H4(l) = 3N2(g)+4H2O(l),若该反应中有4 mol N—H键断裂,则形成的π键数目为1.5NA
D. 在硅酸盐中,SiO44-四面体通过共用顶角氧离子形成一种无限长单链结构的多硅酸根如图,其中Si原子的杂化方式与图中S8单质中S原子的杂化方式相同
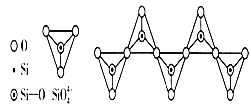
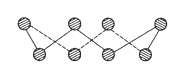
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验室中的常用物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑
(2)装置连接好实验仪器,这时可以听见耳机发出“嚓嚓嚓…”的声音。其原因是在原电池中化学能转化为电能,在耳机中__又转化为声波这种能量。
(3)在该原电池中,Fe在__极发生了__反应,H+在__极发生了_反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性锌锰干电池在放电时,电池的总反应方程式可以表示为: Zn+2MnO2 +2H2O = Zn(OH)2 +2MnOOH。电池放电时,负极上发生反应的物质是
A.Zn B.碳棒 C.MnO2 D.MnO2和H2O
【答案】A
【解析】
试题分析:根据总反应方程式可知Zn在反应中失去电子,发生氧化反应,所以作原电池的负极,MnO2得到电子,发生还原反应,作原电池的正极。因此答案是选项A。
考点:考查根据原电池反应原理确定电池的电极材料的知识
【题型】单选题
【结束】
17
【题目】在恒容隔热容器中,下列说法可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是( )
2NH3已达到平衡状态的是( )
①1mol N≡N键断裂的同时,有6mol N-H键断裂
②v(H2)=0.9 mol·L-1·min-1,v(NH3)=0.6 mol·L-1·min-1
③保持其他条件不变时,体系气体密度不再改变
④NH3、N2、H2的体积分数都不再改变
⑤体系温度不再改变
A. ②③④ B. ①③⑤ C. ①④⑤ D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如下图所示,下列说法正确的是
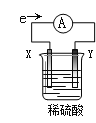
A.外电路的电流方向为:X→外电路→Y
B.X极上发生的是还原反应
C.溶液中氢离子向X极移动
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中浓度关系正确的是( )
A. 小苏打溶液中:c(Na+)+c(H+)=c(HCO)+c(CO![]() )+c(OH-)
)+c(OH-)
B. CH3COONa溶液中:c(CH3COO-)>c(Na+)
C. 物质的量浓度相等的CH3COOH溶液和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
D. 0.1 mol/L的NaHA溶液,其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝试剂,其脱硝反应为:2NO2(g)+O3(g) ![]() N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A | B | C | D |
|
|
|
|
升高温度,平衡常数减小 | 0~3 s内,反应速率为:v(NO2)=0.2 mol/L | t1时仅加入催化剂,平衡正向移动 | 达平衡时,仅改变x,则x为c(O2) |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是( )
A.实验室用H2O2分解制O2,加入MnO2后,反应速率明显加快
B.在金属钠与足量水反应中,增加水的量能加快反应速率
C.2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D.实验室用碳酸钙和盐酸反应制取CO2,用粉末状碳酸钙比块状反应要快
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com