
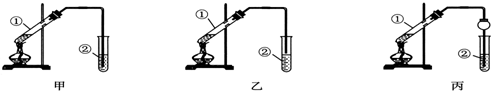
分析 【实验原理】乙酸与乙醇在浓硫酸作用下加热反应生成乙酸乙酯和水,该反应为可逆反应;
【装置设计】装置中②的导管不能伸入液面以下,否则容易发生倒吸现象,则装置甲会发生倒吸现象,装置乙合理;丙中球形干燥管还可以防止倒吸;
【问题讨论】生成乙酸乙酯蒸气,需要检验气密性,饱和碳酸钠溶液可与乙酸反应,使之转化为乙酸钠溶于水中,可吸收乙醇,乙酸乙酯不溶于水,溶液分层,以此解答该题.
解答 解:【实验原理】乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
【装置设计】乙酸和乙醇易溶于水,不插入液面下是为了防止倒吸,所以选乙装置;球形干燥管导气的同时也起到防倒吸作用,
故答案为:乙;防止倒吸;
【问题讨论】(1)生成乙酸乙酯蒸气,需要检验气密性,故答案为:装置的气密性;
(2)反应结束后,振荡试管②,静置.观察到的现象是②中的液体分层,上层是透明的油状液体,
故答案为:液体分为两层;
(3)试管②中加有饱和Na2CO3溶液,其作用是反应掉挥发出来的乙酸;溶解挥发出来的乙醇;减小乙酸乙酯的溶解度,使溶液分层,便于得到乙酸乙酯,因乙酸乙酯在氢氧化钠溶液中水解,不能用氢氧化钠溶液代替饱和碳酸钠溶液,
故答案为:溶解乙醇,除乙酸、降低乙酸乙酯的溶解度;不能;NaOH与乙酸乙酯反应,促进乙酸乙酯的水解.
点评 本题考查有机物的制备实验,为高频考点,把握制备实验操作、混合物分离提纯、有机物的性质为解答的关键,侧重分析与实验能力的考查,注意实验安全的分析,题目难度不大.


科目:高中化学 来源: 题型:填空题
 反应类型取代反应
反应类型取代反应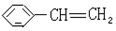 使溴水褪色的反应方程式
使溴水褪色的反应方程式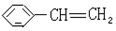 +Br2→
+Br2→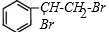 反应类型加成反应
反应类型加成反应 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH和Al2(SO4)3 | B. | NaOH和Ca(HCO3)2 | C. | NaAlO2和 HCl | D. | K2CO3和HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
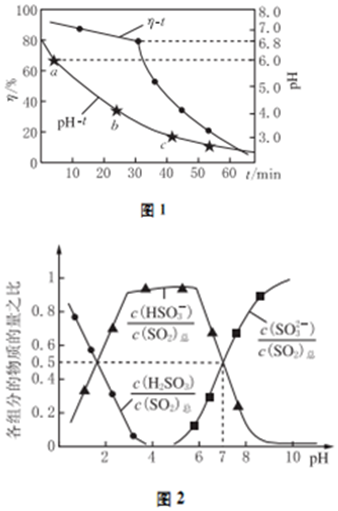
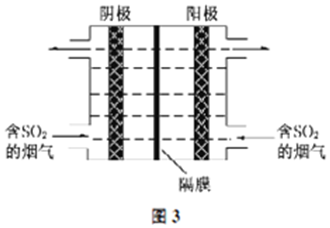
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
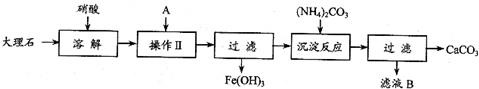
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①表示2molC(s)燃烧生成2molCO(g)需要吸收221 kJ的热量 | |
| B. | 碳的燃烧热大于110.5 kJ/mol | |
| C. | 稀硫酸与浓NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
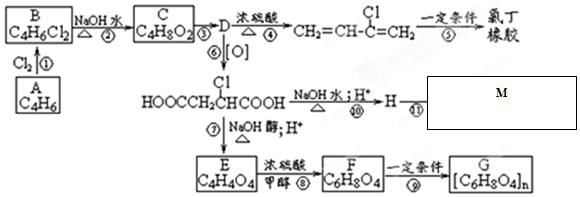

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -OH | B. | -COOH | C. | -C 6H 5 | D. | -NH 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com