
| A. | 中国古代利用明矾溶液淸除铜镜表面的铜锈,是利用了明矾的酸性 | |
| B. | 碘是人体内必须的微量元素,所以富含高碘酸钾的食物适合所有人群 | |
| C. | “光化学烟雾”“臭氧空洞”、“硝酸型酸雨”的形成都与氮氧化合物有关 | |
| D. | 用加入足量氢氧化钠溶液共热的方法可以区分地沟油与矿物油 |
分析 A.明矾水溶液中,铝离子水解显酸性;
B.碘是人体必须微量元素,每人每天大约吃食盐12克,多吃无益;
C.依据光化学烟雾、臭氧空洞、酸雨的成因解答;
D.油脂在碱性条件下,矿物油成分是烃类,不水解.
解答 解:A.明矾水溶液中,铝离子水解显酸性,可以与碱式碳酸铜反应生成易溶性盐,故A正确;
B.碘是人体必需微量元素,所以要吃富含KIO3的食盐,但不能多吃,多吃会导致升高血压,促进动脉粥样硬化,故B错误;
C.“光化学烟雾“、“臭氧空洞“、“硝酸酸雨“的形成都与氮氧化合物有关,故C正确;
D.地沟油的成分是油脂,油脂在碱性条件下,矿物油成分是烃类,不水解,所以用加入足量氢氧化钠溶液共热的方法可以区分地沟油与矿物油,故D正确;
故选:B.
点评 本题考查了元素化合物的性质及用途,题目难度不大,考查了化学知识在生产生活中的应用,注意把握常见物质的性质和用途.


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有共价键的化合物一定是共价化合物 | |
| B. | 分子中只有共价键的化合物一定是共价化合物 | |
| C. | 离子化合物中只能含离子键 | |
| D. | 只有非金属原子间才能形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 终点溶液偏碱性 | B. | 终点溶液中c(NH4+)=c(Cl-) | ||
| C. | 终点溶液中氨过量 | D. | 合适的指示剂是甲基橙而非酚酞 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L CH2C12含极性共价键数目为2NA | |
| B. | 含1 mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+的数目大于NA | |
| C. | 4.6g甲苯(C7H8)和丙三醇(C3H8O3)混合物中含H原子数目为0.4NA | |
| D. | 将1mol Cl2通入足量水中,溶液中HC1O、Cl-、ClO-粒子数之和为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释与结论 |
| A | 室温下,向浓度均为0.1mol•L-1的KCl和KI混合溶液中滴加AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 无水乙醇与浓硫酸共热至170℃,将产生的气体通入溴水 | 溴水褪色 | 乙烯和溴水发生加成反应 |
| C | 向物质的量浓度、体积均相同的Na2CO3和NaHCO3溶液中各滴加1滴酚酞 | 变红,前者红色更深 | 水解程度:CO32->HCO3- |
| D | 将Fe(NO3)2样品溶于稀H2SO4,滴加KSCN溶液 | 溶液变红 | 原Fe(NO3)2样品溶于酸前已氧化变质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
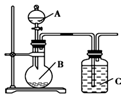 某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )
某研究性学习小组根据元素非金属性与其最高价氧化物对应的水化物之间的关系,设计了如图装置来一次性完成S、C、Si的非金属性强弱比较的实验研究,下列关于试剂B选择正确的是( )| A. | 稀H2SO4 | B. | Na2SO4溶液 | C. | Na2CO3溶液 | D. | Na2SiO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:| 方法I | 用碳粉在高温条件下还原CuO |
| 方法II | 用肼(N2H4)还原新制Cu(OH)2 |
| 方法III | 电解法,反应为2Cu+H2O$\frac{\underline{\;电解\;}}{\;}$Cu2O+H2↑ |
| 序号 | Cu2O a克 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | 方法II | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | 方法III | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | 方法III | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com