
| A. | 油脂是高分子化合物 | |
| B. | 氨基酸和蛋白质既能与酸反应,又能与碱反应 | |
| C. | 甲酸乙酯、葡萄糖、麦芽糖、淀粉这四种物质的共同性质是他们既可以发生水解反应,又可以发生银镜反应 | |
| D. | 蛋白质溶液遇硫酸铜产生的沉淀能重新溶于水 |
 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4$\stackrel{高温}{→}$C+2H2 | |
| B. | CH3CH═CH2+Br2$\stackrel{CCI_{1}}{→}$CH3CHBrCH2Br | |
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| D. | Cl2+C2H6$\stackrel{光}{→}$C2H5Cl+HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到反应限度时,生成 SO3 为2 mol | |
| B. | 达到反应限度时,反应放出 197 kJ 的热量 | |
| C. | 达到反应限度时SO2、O2、SO3的分子数之比一定为2:1:2 | |
| D. | 达到反应限度时SO2的消耗速率必定等于SO3的消耗速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
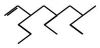 命名正确的是( )
命名正确的是( )| A. | 5,7-二甲基-3-乙基-1-辛烯 | B. | 3-乙基-5,7-二甲基-1-壬烯 | ||
| C. | 3-甲基-5-乙基-7-丙基-8-壬烯 | D. | 7-甲基-5-乙基-3-丙基-1-壬烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 | |
| B. | 元素X与元素Y形成的化合物X2Y2中既有极性共价键又有非极性共价键 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY<XmR | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 砷的一些化合物常用作半导体、除草剂、杀鼠药等.回答下列问题:
砷的一些化合物常用作半导体、除草剂、杀鼠药等.回答下列问题:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com