
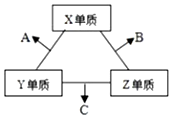
| A. | X与Z形成的某种化合物可用来杀菌消毒 | |
| B. | C极易溶于B中,溶液呈碱性 | |
| C. | Y与Z形成的二元化合物只含有极性键 | |
| D. | A和C能发生氧化还原反应 |
分析 B和C均为10电子分子,考虑为氢化物,由转化关系可知,Z为氢,X、Y、Z原子序数之和为16,则X、Y的原子序数之和为15,原子半径Y>X,则Y为碳元素、X为氟元素或者Y为氮元素、X为氧元素,由转化关系,单质X、Y反应生成A,单质Y、Z生成B,则Y应为氮元素、X应为氧元素,则A为NO、B为H2O、C为NH3,验证符合转化关系,据此解答.
解答 解:A.根据以上分析,X为氧元素,Z为氢,则X与Z形成的H2O2可用来杀菌消毒,故A正确;
B.B为H2O、C为NH3,则C极易溶于B中形成氨水,溶液呈碱性,故B正确;
C.根据以上分析,Y为氮元素,Z为氢,则Y与Z不能形成二元化合物,故C错误;
D.A为NO、C为NH3,则氨气与NO可以发生归中反应生成氮气与水,故D正确;
故选C.
点评 本题考查元素及无机物的推断、元素化合物性质等,难度中等,推断元素与物质是解题的关键,注意掌握常见10电子物质,利用猜测验证法进行推断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
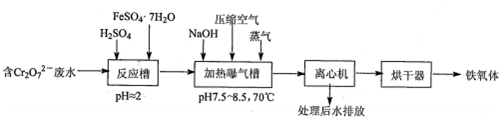
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
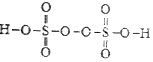 ,H2O2的电子式为
,H2O2的电子式为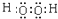 ,过二硫酸中氧元素的化合价为-1、-2价.
,过二硫酸中氧元素的化合价为-1、-2价.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 LHF中所含共价键数目为NA | |
| B. | 已知某FeCl3溶液中Fe3+的物质的量为1 mol,则Cl-的数目大于3NA | |
| C. | 100 g含氢元素质量分数为12%的乙烯和乙醛(C2H4O)的混合物中,所含氧原子数目为NA | |
| D. | 在一定条件下,0.2mol NH3充分分解,生成N2的物质的量小于0.1mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L己烷中含有的碳碳键数为2.5NA | |
| B. | 2molNO和1molO2在密闭容器中充分反应,反应后容器中的分子数小于2NA | |
| C. | 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA | |
| D. | 1molNa与O2完全反应.生成Na2O和Na2O2的混合物,转移电子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将lmolCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(C12)](N表示粒子数) | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2 Na | |
| C. | 1mol葡萄糖与足量的钠反应能产生2.5mol H2 | |
| D. | 相同质量的Na2O2和Na2S固体具有相同的阴阳离子数和质子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XX化妆品从纯天然植物中提取,不含任何化学物质 | |
| B. | 红宝石、玛瑙、水晶、钻石等制作装饰品的材枓,其物质的主要成份都是硅酸盐 | |
| C. | 氢氧燃料电池、硅太阳能电池中都利用了原电池原理 | |
| D. | 镧镍合金能大量吸收H2形成金属氢化物,可作储氢材科 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,纯水的电离度为10-7×100% | |
| B. | 不能用溴水区分生物柴油和汽油 | |
| C. | 海水淡化可使用冷冻法、离子交换法、电解法、反渗透法、明矾吸附法 | |
| D. | 开发,有利于节省化石燃料,并减少温室效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com