
����Ŀ���ҹ���ѧ�Һ�°����NaHCO3�ܽ�ȱ�NaCl��Na2CO3��NH4HCO3��NH4Cl��С�����ʣ�����CO2+NH3+H2O+NaCl=NaHCO3��+NH4Cl�ķ�Ӧԭ���Ʊ������������ʵ���ҽ���ģ��ʵ�����������ʾ��ͼ��
����������������ǣ�����
A. A������NH3��B������CO2
B. �Ѵ���ڢõ��ľ�����ijЩ�����������ʣ����ʯ�ᣩ��Ͽ��Ƶ÷��ͷ�
C. ����ɹ㷺�����ڲ�������������ֽ����֯�ȹ�ҵ��
D. �ڢ��������ǽ���������ˮ����ȡ��������ᾧ
���𰸡�D
��������
A. ���ݺ�°��Ƽ��ԭ���ǣ����ı���ʳ��ˮ��ͨ�������̼��������̼�����ƣ����ȷ�Ӧ�Ʊ���
B. ���ͷ���һ�ָ������Ӽ�����Ҫ��������Ʒ����ʳƷ�����������ͷ��к����������ʣ���Ҫ�ɷ�Ϊ̼�����ƺ;�ʯ�ᣬͨ����̼���κ�̬��Ļ����
C. ���ݴ������;�����жϣ�
D. ̼�����������ֽ�õ�̼���ơ�
A. ���ݺ�°��Ƽ��ԭ���ǣ����ı���ʳ��ˮ��ͨ�������̼��������̼�����ƣ����ȷ�Ӧ�Ʊ�����ʳ��AΪ������BΪ������̼����A����ȷ��
B. ����ڢõ��ľ���Ϊ̼�����ƾ��壬����ijЩ������������(���ʯ��)��Ͽ��Ƶ÷��ͷۣ���B����ȷ��
C. ̼��������Ҫ�Ļ���ԭ��֮һ����;�㷺���Dz�����������ϴ�Ӽ�����֯���Ƹ���ϡ�Ⱦ�ϡ�ҩƷ�ȵ���Ҫԭ�ϣ���C����ȷ��
D. �ڢ��������ǽ�����̼������ֱ�Ӽ��ȷֽ�õ�̼���ƹ��壬��D�����
��ѡD��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ױ�(![]() )��һ����Ҫ�Ļ���ԭ�ϣ���������������ȩ(
)��һ����Ҫ�Ļ���ԭ�ϣ���������������ȩ(![]() )��������(
)��������(![]() )�Ȳ�Ʒ���±��г����й����ʵIJ����������ʣ���ش�
)�Ȳ�Ʒ���±��г����й����ʵIJ����������ʣ���ش�
���� | ��״ | �۵㣨�棩 | �е㣨�棩 | ����ܶ� ����ˮ=1g/cm3�� | �ܽ��� | |
ˮ | �Ҵ� | |||||
�ױ� | ��ɫҺ����ȼ�ӷ� | -95 | 110.6 | 0.8660 | ���� | ���� |
����ȩ | ��ɫҺ�� | -26 | 179 | 1.0440 | �� | ���� |
������ | ��ɫƬ״����״���� | 122.1 | 249 | 1.2659 | �� | ���� |
ע���ױ�������ȩ�������������ܡ�
ʵ���ҿ�����ͼװ��ģ���Ʊ�����ȩ��ʵ��ʱ��������ƿ�м���0.5g��̬�����Դ������ټ���15mL������(��Ϊ�ܼ�)��2mL�ױ�������������70�棬ͬʱ��������12mL�������⣬�ڴ��¶��½��跴Ӧ3Сʱ��

��1��װ��a��������__________________����Ҫ������____________________��
��2������ƿ�з�����Ӧ�Ļ�ѧ����ʽΪ_______________________________________���˷�Ӧ��ԭ�������������Ͽɴ�___________����ԭ��������=(���������������/ȫ����Ӧ���������)��100%��
��3�����ⶨ����Ӧ�¶�����ʱ���ױ���ת�����������¶ȹ���ʱ������ȩ�IJ���ȴ�������٣����ܵ�ԭ����________________________________________________��
��4����Ӧ��Ϻ�Ӧ���Һ������Ȼ��ȴ������ʱ����Ӧ���� ________��________(���������)�Ȳ��������ܵñ���ȩ�ֲ�Ʒ��
��5��ʵ���м���������������ҷ�Ӧʱ��ϳ�����ʹ����ȩ��Ʒ�в����϶�ı����ᡣ����ӻ��б�����ı���ȩ�з���������ᣬ��ȷ�IJ���������_______(������˳������ĸ)��
a.�Ի��Һ���з�Һ b.���ˡ�ϴ�ӡ�����
c.ˮ���м����������pH��2 d.��������̼��������Һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ȷ����
A. 2NO2(g)(����ɫ)![]() N2O4(g)(��ɫ)����H<0����ƽ���ƽ����ϵ��ȡ��С�ݻ�������ѹǿ�Ĵ�ʩ����Ϊƽ��������Ӧ�����ƶ�������ϵ��ɫ��dz
N2O4(g)(��ɫ)����H<0����ƽ���ƽ����ϵ��ȡ��С�ݻ�������ѹǿ�Ĵ�ʩ����Ϊƽ��������Ӧ�����ƶ�������ϵ��ɫ��dz
B. ����C(s) + O2(g) ![]() 2CO(g) ����ƽ�����̼��ƽ��������Ӧ�����ƶ�
2CO(g) ����ƽ�����̼��ƽ��������Ӧ�����ƶ�
C. FeCl3+3KSCN![]() Fe(SCN)3(��ɫ)+3KCl����ƽ�������KCl����Ϊƽ�����淴Ӧ�����ƶ�������ϵ��ɫ��dz
Fe(SCN)3(��ɫ)+3KCl����ƽ�������KCl����Ϊƽ�����淴Ӧ�����ƶ�������ϵ��ɫ��dz
D. ����N2+3H2![]() 2NH3��ƽ���ѹǿ���䣬����O2��ƽ�����淽���ƶ�
2NH3��ƽ���ѹǿ���䣬����O2��ƽ�����淽���ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״���£���22.4LHCl��ȫ����1Lˮ�У�ˮ���ܶȽ���Ϊ1g/mL������Һ���ܶ�Ϊ��g/cm3������1������Һ�����ΪVmL�����ʵ���������Ϊw�����ʵ����ʵ���Ũ��Ϊc mol/L��������������ȷ���ǣ� ��
��w=![]() ��100% ��c=1molL��1 ����������Һ���ټ���VmLˮ��������Һ��������������0.5w����������Һ���ټ���VmLˮ��������Һ����������С��0.5w
��100% ��c=1molL��1 ����������Һ���ټ���VmLˮ��������Һ��������������0.5w����������Һ���ټ���VmLˮ��������Һ����������С��0.5w
A. �٢ڢ�B. �٢ۢ�C. �٢�D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2AΪ��Ԫ���ᡣ20��ʱ������һ��c(H2A)+c(HA��)+c(A2��)��0.100molL��1��H2A��NaOH�Ļ����Һ����Һ�в����������ʵ���Ũ����pH�ı仯��������ͼ��ʾ������ָ����Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ����(����)

A. H2A��Ka1��10��1.2
B. pH��4.2����Һ�У�c(HA��)��c(A2��)��0.050 molL��1
C. pH��7����Һ�У�c(Na+)��2c(A2��)+c(H+)
D. c(Na+)��0.150 molL��1����Һ�У�2c(OH��)+c(HA��)+3c(H2A)��2c(H+)+c(A2��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڱ�״���¢�6.72L CH4��3.01��1023��HCl���Ӣ�13.6g H2S��0.2mol NH3�����������____���������Ƕ�___��������С����___����ԭ�Ӹ���������____������д��ţ�
��2�����µ�ѹ�£���������ȵ�CO��N2�������壬����֮��Ϊ____�����֮��Ϊ____��Ħ������֮��____��
��3��ij������һ�������¼��ȷֽ⣬���ﶼ�����塣�ֽⷽ��ʽΪ��3A��B��3C��2D��������ɵĻ�������ƽ����Է�������Ϊ2a����A��Ħ������Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��Ӧ���ͷ�����ԭ�Ӿ��������ǣ� ��
A.�û���ӦB.ȡ����ӦC.�ֽⷴӦD.�Ӿ۷�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ۺ�����CO2�Ի����������ܿ��������ش�
��1��Li2O��Na2O��MgO��������CO2�����Ѱ������CO2���������ʣ����н����������______________��
a. ���ڼ�����������Ѱ��
b. ������A����A��Ԫ���γɵ���������Ѱ��
c. ���ھ���ǿ�����Ե�������Ѱ��
��2��Li2O����CO2�������ںϳ�Li4SiO4��Li4SiO4�������ա��ͷ�CO2��ԭ���ǣ���500����CO2��Li4SiO4�Ӵ�������Li2CO3��ƽ��������700������Ӧ������У��ų�CO2��Li4SiO4������˵����ԭ���Ļ�ѧ����ʽ��__________________________��
��3�����÷�ӦA�ɽ��ͷŵ�CO2ת��Ϊ���й�ҵ���ü�ֵ�IJ�Ʒ��
��ӦA��CO2+H2O![]() CO+H2+O2����֪��
CO+H2+O2����֪��
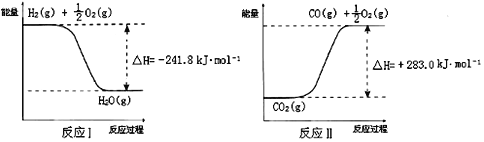
��ӦA���Ȼ�ѧ����ʽ��___________________________����ϡ��ˮ��������CO2���տɵò�ƷNH4HCO3���ڲ���ʱ�����������м���NH2COONH4����������泥����ɣ��ֽ�һ���������İ�����������ں��ݵ��ܱ���������У��ֱ��ڲ�ͬ�¶��½��з�Ӧ��NH2COONH4��s��![]() 2NH3��g��+CO2��g����ʵ���õ��й����ݼ��ϱ����� t1��t2��t3����������立ֽⷴӦ��________��Ӧ��������������������������15�棬�˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ��__________��
2NH3��g��+CO2��g����ʵ���õ��й����ݼ��ϱ����� t1��t2��t3����������立ֽⷴӦ��________��Ӧ��������������������������15�棬�˷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ��__________��

��4�����µ�⼼���ܸ�Чʵ�֣�3���з�ӦA������ԭ��ʾ��ͼ���£�

�� �缫b����______________�����������ԭ������Ӧ��
�� CO2�ڵ缫a�ŵ�ķ�Ӧʽ��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ֱ�ȡδ֪Ũ�ȵ�HA��MOH��Һ����ˮϡ����ԭ�������n����ϡ�����У�����Һ��pH�仯��ͼ��ʾ������������ȷ����(����)

A. HAΪ���ᣬMOHΪǿ��
B. ˮ�ĵ���̶ȣ�X��Y=Z
C. �������¶ȣ�Y��Z���Ӧ��Һ��pH����С
D. ��Y����Z���Ӧ��Һ�������Ϊ1��10��ϣ�������Һ�У�c(M+)>c(A-)>c(OH-)>c(H+)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com