
| 分类 组合 | 碱 | 酸 | 盐 | 碱性 氧化物 | 酸性 氧化物 |
| A | Na2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
| B | NaOH | HCl | NaCl | Al2O3 | CO2 |
| C | NaOH | NaHSO4 | CaF2 | Na2O2 | SO2 |
| D | KOH | HNO3 | CaCO3 | CaO | SO3 |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
| A、2A(l)+B(l)═2C(g)△H=-Q1kJ/mol |
| B、2A(g)+B(g)═2C(g)△H=-Q2kJ/mol |
| C、2A(g)+B(g)═2C(l)△H=-Q3kJ/mol |
| D、2A(l)+B(l)═2C(l)△H=-Q4kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | (1) | (2) | (3) | (4) | (5) |
| 操作 | a+b | a+e | b+c | b+d | d+f |
| 反应 现象 | 产生白色 沉淀 | 有无色气体 产生 | 产生白色 沉淀 | 产生白色 沉淀 | 溶液呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是物质的数量单位,含有6.02×1023个微粒的物质叫做1摩尔 |
| B、1mol氧含有6.02×1023个氧原子 |
| C、在标准状况下,任何物质的摩尔体积约为22.4L/mol |
| D、一定质量的气体的体积随压强增大和温度降低而变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
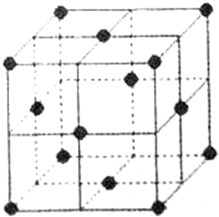 铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.
铝是地壳中含量最高的金属元素,在所有的元素中位居第三位.- 4 |
- 4 |
| I1 | I2 | I3 | I4 | … |
| 496 | 4562 | 6912 | 9540 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com