
| A、CaCO3沉淀生成和沉淀溶解不断进行,但速率相等 |
| B、CaCO3难溶于水,溶液中没有Ca2+和CO32- |
| C、升高温度,CaCO3沉淀的溶解度无影响 |
| D、向CaCO3沉淀中加入Na2CO3固体,CaCO3沉淀的溶解度不变 |


科目:高中化学 来源: 题型:
| A、所得溶液中的c(H+)=1.0×10-13mol?L-1 |
| B、所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol?L-1 |
| C、所得溶液中的c(Mg2+)=5.6×10-10 mol?L-1 |
| D、298K时,饱和Mg(OH)2的溶液与饱和MgF2溶液相比前者的c(Mg2+)大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃、101kPa 下,Na2O2(s)+2 Na(s)=2Na2O(s)△H=-317kJ/mol |
| B、①和②生成等物质的量的产物,转移电子数不同 |
| C、常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 |
| D、①和②产物的阴阳离子个数比不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、2H2SO4(浓)+Cu
| ||||
B、2H2SO4 (浓)+C
| ||||
C、H2SO4 (浓)+NaCl
| ||||
| D、H2SO4+Na2SO3═Na2SO4+H2O+SO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
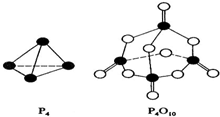
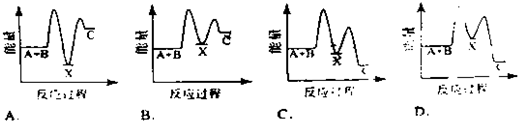
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硝酸和氯水用棕色试剂瓶保存 |
| B、硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C、常温下铁和铂都不溶于浓硝酸 |
| D、SO2和Na2SO3溶液都能使氯水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12,如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )(提示:KspAgCl>KspAgI)
已知:pAg=-lg{c(Ag+)},KspAgCl=1×10-12,如图是向10mL AgNO3溶液中逐渐加入0.1mol/L的NaCl溶液时,溶液的pAg随着加入NaCl溶液的体积(单位mL)变化的图象(实线).根据图象所得下列结论正确的是( )(提示:KspAgCl>KspAgI)| A、原AgNO3溶液的物质的量浓度为0.1 mol?L-1 |
| B、图中x点的坐标为(100,6 ) |
| C、图中x点表示溶液中Ag+与Cl-浓度相同 |
| D、把0.1 mol?L-1的NaCl换成0.1 mol?L-1NaI则图象在终点后变为虚线部分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com