
氨基甲酸铵(NH2COONH4)是一种白色固体,可用做肥料、灭火剂、洗 涤剂等。制备氨基甲酸铵的化学方程式如下:2NH3(g)+CO2(g) NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
a.常温下在干燥的空气中稳定,遇水生成碳酸铵或碳酸氢铵;
b. 59℃则可分解成NH3和CO2气体;
用如图I装置制备干燥的氨气,图II装置制备氨基甲酸铵,把制备的干燥的氨气和二氧化碳通入四氯化碳中不断搅拌混合,当生成的氨基甲酸铵晶体悬浮在四氯化碳中较多时停止制备(注:四氯化碳与液体石蜡均为惰性介质)。

请回答下列问题:
(1)图I中,仪器B的名称 , A中的化学反应方程式是 ;
(2)图II装置中使用冰水的原因是 ;
(3)图II中液体石蜡鼓泡瓶的作用是 ;
(4)从图II反应后的混合物中分离出产品的方法是 ;
 A.蒸馏 B.过滤 C.分液 D.结晶
A.蒸馏 B.过滤 C.分液 D.结晶
(5)图II装置中,尾气处理装置如右图所示,玻璃管的作用 ,浓硫酸的作用是 和防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品7.82 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为10.0 g,则样品中氨基甲酸铵的质量分数为 (计算结果精确至0.1%)
【知识点】化学实验操作原理、简单计算
【答案解析】 (第一空1分,其余每空2分,共15分)
(1)干燥管 CaO+NH3·H2O= Ca(OH)2+ NH3↑
(2)降低温度,提高产物产率(其它合理答案也可)
(3)通过观察气泡,调节NH3与CO2通入比例(其它合理答案也可)
(4)B (5)防止倒吸 吸收多余氨气 (6)79.8%
解析:(1)仪器B用来干燥生成的氨气,为球形干燥管。A中用CaO生成氨气得方程式:
CaO+NH3·H2O= Ca(OH)2+ NH3↑(2)制备氨基甲酸铵的反应为放热反应,使用冰水降低温度,提高产物产率,防止氨基甲酸铵59℃则可分解。(3)液体石蜡鼓泡瓶的作用使气体混合均匀,也可根据气泡的多少调节调节NH3与CO2通入比例。(4)白色固体氨基甲酸铵悬浮在四氯化碳中,用过滤的方法分离。(5)粗玻璃管有防止倒吸的作用;浓硫酸的作用是防止空气中水蒸气进入反应器和吸收尾气(多余的氨气)的作用。(6)设氨基甲酸铵的物质的量为x设碳酸氢铵的物质的量为y得方程78x+79y=7.82 根据碳原子守恒得方程x+y=0.1 解方程得x=0.08, 则样品中氨基甲酸铵的质量分数为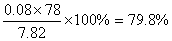
【思路点拨】本题主要考查化学实验操作原理,如装置名称、操作原理,简单计算等,需要平时的积累,计算运用关系式设未知数即可。难度中等。


科目:高中化学 来源: 题型:
某温度下,对于反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4 kJ·mol-1。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量 为92.4 kJ
为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增 大压强,H2的转化率增大
大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸亚铁铵又称莫尔盐,是浅绿色晶体。它在空气中比一般亚铁盐稳定,是常用的Fe2+试剂。某实验小组利用工业废铁屑制取莫尔盐,并测定其纯度。
已知:①
②莫尔盐在乙醇溶剂中难溶。
Ⅰ.莫尔盐的制取

试分析:
(1)步骤2中加热方式 (填“直接加热”﹑“水浴加热”或“沙浴”);必须在铁屑少量剩余时,进行热过滤,其原因是 。
(2)步骤3中包含的实验操作名称 。
(3)产品莫尔盐最后用 洗涤(填字母编号)。
a.蒸馏水 b.乙醇 c.滤液
Ⅱ.为测定硫酸亚铁铵(NH4)2SO4•FeSO4•6H2O晶体纯度,某学生取m g硫酸亚铁铵样品配制成500 mL溶液,根据物质组成,甲、乙、丙三位同学设计了如下三个实验方案,请回答:
(甲)方案一:取20.00 mL硫酸亚铁铵溶液用0.1000 mol·L-1的酸性KMnO4溶液分三次进行滴定。
(乙)方案二:取20.00 mL硫酸亚铁铵溶液进行如下实验。

(1)若实验操作都正确,但方案一的测定结果总是小于方案二,其可能原因为
,验证推测的方为: 。
(丙)方案三:(通过NH4+测定)实验设计图如下所示。取20.00 mL硫酸亚铁铵溶液进行该实验。


(2)①装置 (填“甲”或“乙”)较为合理,判断理由是 。量气管中最佳试剂是 (填字母编号。如选“乙”则填此空,如选“甲”此空可不填)。
a.水 b.饱和NaHCO3溶液 c.CCl4
②若测得NH3的体积为V L(已折算为标准状况下),则该硫酸亚铁铵晶体的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H2CO3的电离平衡常数Ka1=4.4×10-7,Ka2=4.7×10-11。向0.1mol/LNaOH溶液中通入CO2,若溶液的pH=10(不考虑溶液的体积变化),则下列说法正确的是
A. 2c(CO32-)+c(HCO3-)=0.1mol/L
B. 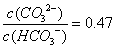
C. 该溶液中加BaCl2溶液,溶液pH增大
D. 在溶液中加水,使体积扩大到原来的10倍,则溶液pH明显变小
查看答案和解析>>
科目:高中化学 来源: 题型:
使用化学手段可以消除某些环境污染。下列主要依靠化学手段消除环境污染的是 ( )
A.在燃煤中添加生石灰 B.将某些废旧塑料融化后再成型
C.把放射性核废料深埋于地下岩层 C.用多孔吸附剂清除水面油污
查看答案和解析>>
科目:高中化学 来源: 题型:
某学生做完实验后,采用下列方法清洗所用仪器:
①用浓氨水清洗做过银镜反应后的试管
②用酒精清洗做过碘升华的烧杯
③用浓盐酸清洗做过高锰酸钾分解实验的试管
④用盐酸清洗长期存放三氯化铁溶液的试剂瓶
⑤用氢氧化钠溶液清洗盛过苯酚的试管
⑥用热氢氧化钠的浓溶液清洗沾有硫磺的试管
下列对以上操作的判断。正确的是 ( )
除①外都对 B.除⑥外都对 C.④⑤不对 D.全都正确
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物的结构简式为: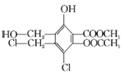 ,下列有关该物质的叙述正确的是
,下列有关该物质的叙述正确的是
A. 1 mol该物质最多可以消耗3 mol Na
B.1 mol该物质最多可以消耗7 mol NaOH
C.不能与Na2CO3溶液反应
D.易溶于水,可以发生加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数的值,下列说法正确的是
NA个Fe(OH)3胶体粒子的质量为107g
B.标准状况下,将2.24 L SO2溶于水中,溶液中H2SO3分子的数目是0.1NA
C.4.6 gN2O4和NO2的混合气体中含有的氧原子数为0.2NA
D.在含有2molH2SO4的浓硫酸中加入足量Zn粉,反应后转移的电子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com