
| A、HClO的结构式:H-Cl-O |
| B、硝基和二氧化氮两种粒子所含电子数相等 |
C、甲烷分子的比例模型是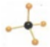 |
D、甲基的电子式: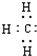 |
 为甲烷的球棍模型;
为甲烷的球棍模型; 为甲烷的球棍模型,甲烷的比例模型为:
为甲烷的球棍模型,甲烷的比例模型为: ,故C错误;
,故C错误; ,故D错误;
,故D错误;

科目:高中化学 来源: 题型:
| A、c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-) |
| B、c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-) |
| C、c(NO3-)>c(K+)>c(Ag+)>c (Cl-)>c(I-) |
| D、c(K+)>c(NO3-)>c(Ag+)=c(Cl-)+c(I-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=-11036kJ/mol | ||
B、C(s)+
| ||
C、H2(g)+
| ||
D、CO(g)+
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两原子如果核外电子排布相同,则一定属于同种元素 |
| B、同主族元素含氧酸的酸性随核电荷数的增加而减弱 |
| C、ⅠA族与ⅦA族元素间只能形成离子化合物 |
| D、非金属元素形成的共价化合物中,原子的最外层都达到了8电子的稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| △ |
| A、0.3mol |
| B、0.15mol |
| C、小于0.15mol |
| D、大于0.15mol,小于0.3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石油、煤、天然气、氢气都属于化石燃料 |
| B、常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的△H<0 |
| C、人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大 |
| D、两个体积相同的容器中充入等量的NO2发生反应:2NO2(g)?N2O4(g)△H<0,绝热容器中气体的颜色比恒温容器中颜色深 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50mL 18.4mol?L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA |
| B、常温常压下,4.6gNO2与N2O4混合气中含有0.3NA个原子 |
| C、1L0.1mol?L-1Na2CO3溶液中含有的阴离子数为0.1NA |
| D、标准状况下,22.4LCCl4中含有NA个分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
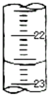 实验室用中和滴定法测定待测烧碱溶液的浓度,试根据实验回答:
实验室用中和滴定法测定待测烧碱溶液的浓度,试根据实验回答:| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com