
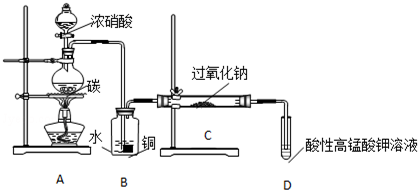
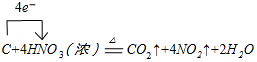 .
.分析 制备NaNO2并对其性质作探究,由实验装置可知,A中发生C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,B中B装置中NO2与水反应生成NO,同时铜与稀硝酸反应也生成NO,C中发生2NO+Na2O2═2NaNO2,D中高锰酸钾吸收尾气NO,
(1)装置A烧瓶中,碳和浓硝酸反应生成二氧化碳、二氧化氮和水,方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)B装置中,NO2与水反应生成NO,同时铜与稀硝酸反应也生成NO;
(3)D中高锰酸钾氧化NO生成 硝酸根离子,高锰酸根离子被还原成锰离子;
(4)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,那么NO中混有CO2、NO2,可以在B、C之间增加装有碱石灰或生石灰的装置E,以吸收杂质CO2、NO2;
(5)NaNO2在酸性条件下不稳定,生成红棕色的二氧化氮,NaNO2具有还原性,能使高锰酸钾溶液褪色,NaNO2具有氧化性,能将亚铁离子氧化成铁离子,或者将碘离子氧化成碘单质,据此答题.
解答 解:(1)装置A烧瓶中,碳和浓硝酸反应生成二氧化碳、二氧化氮和水,反应的化学方程式并标出电子转移的方向和数目为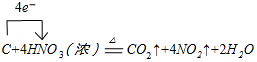 ,
,
故答案为: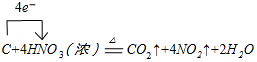 ;
;
(2)B装置中,NO2与水反应生成NO,同时铜与稀硝酸反应也生成NO,故答案为:将NO2转化为NO,同时铜与稀硝酸反应生成NO;
(3)D中高锰酸钾氧化NO生成 硝酸根离子,高锰酸根离子被还原成锰离子,反应的离子方程式为5NO+3MnO4-+4H+=5 NO3-+3Mn2++2H2O,
故答案为:5NO+3MnO4-+4H+=5 NO3-+3Mn2++2H2O;
(4)有同学认为装置c中产物不仅有亚硝酸钠,还有碳酸钠和氢氧化钠,那么NO中混有CO2、NO2,可以在B、C之间增加装有盛放碱石灰的干燥管(或U形管),以吸收杂质CO2、NO2,
故答案为:盛放碱石灰的干燥管(或U形管);
(5)NaNO2在酸性条件下不稳定,生成红棕色的二氧化氮,NaNO2具有还原性,能使高锰酸钾溶液褪色,NaNO2具有氧化性,能将亚铁离子氧化成铁离子,或者将碘离子氧化成碘单质,
①利用HNO2的不稳定性,向取样溶液中加入稀H2SO4,观察到的现象是产生红棕色气体;
②利用NO2-的还原性,向取样溶液中加入酸性KMnO4溶液,观察到的现象是酸性KMnO4溶液;
③利用NO2-的氧化性,向取样溶液中加入FeCl2溶液和KSCN溶液,观察到的现象是溶液变红,或者向取样溶液中加入淀粉KI溶液,观察到的现象是溶液变蓝,
故答案为:①稀H2SO4,产生红棕色气体; ②酸性KMnO4溶液,紫色褪去;③FeCl2溶液和KSCN溶液,溶液变红(或淀粉KI溶液,溶液变蓝).
点评 本题是一道实验方案的设计和探究题,考查学生分析和解决问题的能力,综合性强,难度大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Fe2+ NO3- Cl- | B. | K+ Mg2+HCO3-SO42- | ||
| C. | S2- Na+ K+、Cl- | D. | Ba2+Na+ I- NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
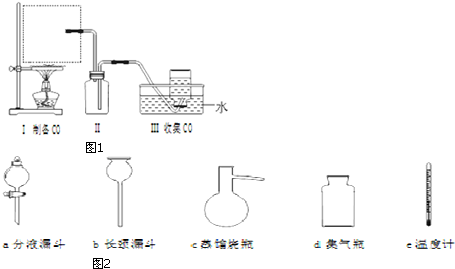
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
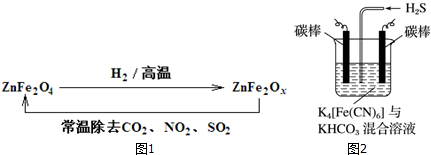
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮的化合物在生产生活中广泛存在.
氮的化合物在生产生活中广泛存在. .可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.
.可通过反应NH3(g)+Cl2(g)=NH2Cl(g)+HCl(g)制备氯胺,已知部分化学键的键能如表所示(假定不同物质中同种化学键的键能一样),则上述反应的△H=+11.3kJ•mol-1.| 化学键 | 键能/(kJ•mol-1) |
| N-H | 391.3 |
| Cl-Cl | 243.0 |
| N-Cl | 191.2 |
| H-Cl | 431.8 |
| t/min | 0 | 40 | 80 | 120 | 160 |
| n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
| n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
| n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
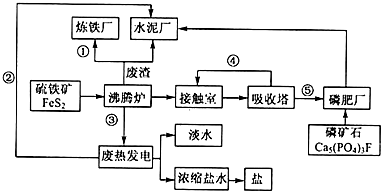 生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.
生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸点(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |
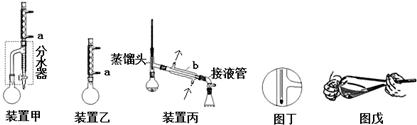
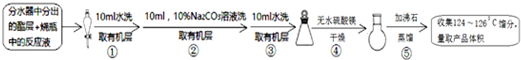
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.请回答下列问题:
云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com