
【题目】磷单质及其化合物有广泛应用。结合所学知识同答下列间题:
(1)磷酸的结构式为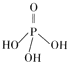 ,二聚磷酸可视为两个磷酸分子之间脱去一个水分子的产物,二聚磷酸钠(俗称“磷酸四钠”)是一种常用的延长混凝土凝结时间的缓凝剂,其化学式为_____。
,二聚磷酸可视为两个磷酸分子之间脱去一个水分子的产物,二聚磷酸钠(俗称“磷酸四钠”)是一种常用的延长混凝土凝结时间的缓凝剂,其化学式为_____。
(2)工业制备PH3的工艺流程如下(部分操作和条件略):
Ⅰ.向黄磷(P4)中加入过量浓NaOH溶液,产生PH3气体和次磷酸钠(NaH2PO2)溶液;
Ⅱ.向NaH2PO2溶液加入过量的稀硫酸,得到次磷酸(H3PO2);
Ⅲ.次磷酸(H3PO2)不稳定,受热易分解产生PH3气体和磷酸(H3PO4)。
①黄磷和烧碱溶液反应的离子方程式为_____,根据题意判断次磷酸属于_____(填“一”“二”或“三”)元酸。
②次磷酸受热分解的化学方程式为_____。
③起始时有1mol P4参加反应,则整个工业流程中共生成_____mol PH3(不考虑产物的损失)。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生下述反应,请配平:
_____Ni2++ H2PO2﹣+ ═ Ni++ H2PO3﹣+ 。
【答案】Na5P3O10 P4+3OH—+3H2O=PH3↑+3H2PO2— 一 2H3PO2![]() PH3↑+ H3PO4 2.5 1;1;H2O;1;1;2H+
PH3↑+ H3PO4 2.5 1;1;H2O;1;1;2H+
【解析】
(1)磷酸分子间通过羟基脱水形成三聚磷酸,所以三聚磷酸的结构式为: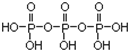 ;三聚磷酸中羟基的氢原子被钠离子取代生成三聚磷酸钠,所以三聚磷酸钠的化学式为:Na5P3O10,故答案为:Na5P3O10;
;三聚磷酸中羟基的氢原子被钠离子取代生成三聚磷酸钠,所以三聚磷酸钠的化学式为:Na5P3O10,故答案为:Na5P3O10;
(2)①由题意可知,黄磷和过量浓NaOH溶液反应生成PH3气体和一元酸盐次磷酸钠,反应的离子方程式为P4+3OH—+3H2O=PH3↑+3H2PO2—;故答案为:P4+3OH—+3H2O=PH3↑+3H2PO2—;一;
②次磷酸受热分解生成PH3气体和磷酸,反应的离子方程式为2H3PO2 ![]() PH3↑+ H3PO4,故答案为:2H3PO2
PH3↑+ H3PO4,故答案为:2H3PO2![]() PH3↑+ H3PO4;
PH3↑+ H3PO4;
③由题意可知,1mol P4与过量浓NaOH溶液反应生成1molPH3气体和3molNa2PO2,3molNa2PO2与过量的稀硫酸反应生成3molH3PO2,3molH3PO2受热易分解产生1.5molPH3气体,则起始时有1molP4参加反应,则整个工业流程中共生成2.5molPH3,故答案为:2.5;
(3)由题意可知,Ni2+和H2PO2﹣反应生成单质Ni和H2PO3-,反应的化学方程式为:H2O+Ni2++H2PO2-+═Ni+H2PO3-+2H+,故答案为:1;1;H2O;1;1;2H+。


科目:高中化学 来源: 题型:
【题目】B、N、F、Ga、As是新一代太阳能电池、半导体材料中含有的主要元素。回答下列问题:
(1)基态Ga原子的核外电子排布式是__________,基态Ga原子核外电子占据最高能级的电子云轮廓图为________。
(2)在第四周期中,与基态As原子核外未成对电子数目相同的元素为__________。
(3)NF3的立体构型为_______。N2F2分子中各原子都满足8电子结构,分子中σ键和π键的个数比为______,氮原子的杂化轨道类型为__________。
(4)B、Al、Ga单质的熔点依次为2300°C,660°C,29.8°C,解释熔点产生差异的原因______。
(5)由B、N、F组成的某离子化合物中,B、N、F的原子个数比为1:1:8,其阴、阳离子互为等电子体,该化合物中的阳离子、阴离子符号分别为__________。
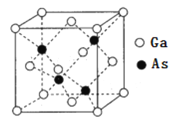
(6)GaAs晶体结构如图所示。
①图中As原子的坐标参数为![]() ,_______。
,_______。
②已知晶胞中相邻且最近的Ga、As原子的核间距为acm,NA为阿伏加德罗常数的值,晶体的密度为___________g/cm3(填写表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,下列溶液的离子浓度关系式正确的是
A.稀释氨水溶液 10 倍后,其 c(OH-)为原来的![]()
B.pH 之和为 14 的 H2C2O4与 NaOH 溶液混合:c(Na+)+c(H+)=c(OH-)+ c(HC2O4-)
C.pH=5 的 H2S 溶液中,c(H+)=c(HS-)=1×10-5mol/L
D.将等物质的量的Na2CO3 和 NaHCO3 混合溶于水中![]() <1
<1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下CH4、H2S、NH3均为气体,分别有①11.2L H2S②16g CH4③1.204×1024个NH3分子,下列物理量大小比较正确的是( )
A. 体积:②>③>①
B. 密度:③>②>①
C. 质量:③>②>①
D. 原子总数:③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】28g CO气体在1mol的氧气中燃烧后,所得的气体通过足量Na2O2固体中充分反应后,下列说法不正确的是( )
A. CO与氧气反应,只消耗了0.5mol氧气
B. 充分反应后Na2O2固体质量增加了28 g
C. 通过以上两步反应后余下氧气物质的量为0.5mol
D. 若2gH2替代 28g的CO发生上述反应,则Na2O2固体质量增加了2g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是________(填化学式),过氧化钠(Na2O2)中氧元素化合价为_____。(填数字)
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_________________。
②每生成1mol FeO42-转移___mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为_____mol。
(3)配平下面化学方程式,回答下列问题:____C +K2Cr2O7+H2SO4=K2SO4+CO2↑+Cr2(SO4)3+H2O。
①H2SO4在上述反应中表现出来的性质是(填选项编号)______。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C. SO2、SO3、BF3、NCl3都是极性分子
D. 向含有0.1 mol [Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液只能生成0.1 mol AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,不正确的是( )
A. 原子半径:X>Y>Z>WB. 原子序数:Y>X>Z>W
C. 原子最外层电子数:Z>W>Y>XD. 金属性:X>Y,还原性:W2->Z-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com