
【题目】下列说法正确的是
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物分子
D.只有非金属原子间才能形成共价键
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.100 g质量分数为98%的浓硫酸中所含有的氧原子数为4 NA
B.足量的Fe与6.72 L Cl2反应转移的电子数为0.6 NA
C.密闭容器中1 molN2与4 molH2反应生成的NH3分子数小于2NA
D.常温常压下,92 g的NO2和N2O4混合气体含有的氧原子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝及其化合物叙述中,不正确的是
A. 不能用铝制的器皿来盛放酸梅汤或碱水
B. 铝可作生活用品材质,因铝的化学性质很稳定
C. 氧化铝既可以用来冶炼铝,也可用作耐火材料
D. 铝热反应可用于焊接钢轨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,当铝完全溶解时,反应中消耗的HCl和NaOH物质的量之比为
A. 1:1B. 2:1C. 1:2D. 3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决大气中CO2的含量增大的问题,某科学家提出“绿色自由”构想:把工厂排出的富含CO2的废气经净化吹入碳酸钾溶液吸收,然后再把CO2从溶液中提取出来,经化学反应使废气中的CO2转变为燃料甲醇.“绿色自由”构想的部分技术流程如图1 
(1)合成塔中反应的化学方程式为;△H<0.从平衡移动原理分析,低温有利于提高原料气的平衡转化率.而实际生产中采用300℃的温度,除考虑温度对反应速率的影响外,还主要考虑了 .
(2)从合成塔分离出甲醇的原理与下列操作的原理比较相符(填字母)
A.过滤
B.分液
C.蒸馏
D.结晶
(3)在体积为2L的合成塔中,充人2mol CO2和6mol H2 , 测得CO2(g)和CH3OH(g)的浓度随时间变化如图2所示. 从反应开始到平衡,V(H2)=;能使平衡体系中 ![]() 增大的措施有 .
增大的措施有 .
(4)如将CO2与H2以1:4的体积比混合,在适当的条件下可制得CH4 . 巳知
CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1=﹣890.3kJ/mol
H2(g)+ ![]() O2(g)═H2O(l)△H2=﹣285.5kJ/mol
O2(g)═H2O(l)△H2=﹣285.5kJ/mol
写出CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】19.2g Cu加入到100mL一定浓度的HNO3溶液中,假定两者恰好完全反应,同时产生标准状态下8.96L NO和NO2混合气体(忽略气体的溶解及转化).求:
(1)混合气体中NO和NO2的体积比?
(2)HNO3溶液的物质的量浓度?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学欲探究Na2O2与水的反应,可供使用的试剂有:Na2O2、蒸馏水、KMnO4酸性溶液、MnO2 . 该同学取一定量Na2O2样品与过量水反应,待完全反应后,得到溶液X和一定量O2 , 该同学推测反应中可能生成了H2O2 , 并进行实验探究.
(1)写出Na2O2与水反应的化学方程式 .
(2)试设计实验证明溶液X中含过氧化氢 .
(3)通过上述实验证明溶液中确实存在H2O2 . 取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀,配平下列反应的离子方程式:H2O2+Fe2++OH﹣﹣﹣Fe(OH)3↓,该反应中H2O2表现了性(填“氧化”或“还原”).
(4)已知溶液X可使酸性KMnO4溶液褪色,同时放出氧气,此时H2O2表现了性(填“氧化”或“还原”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂用软锰矿(含MnO2及少量Al2O3)和闪锌矿(含ZnS及少量FeS)联合生产Zn、MnO2 , 其部分生产流程如下: 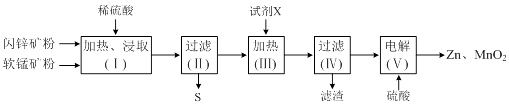
已知:过滤(Ⅱ)所得滤液是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算)如下表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 | Mn(OH)2 |
开始沉淀时的pH | 2.7 | 4.0 | 6.4 | 7.7 |
完全沉淀时的pH | 3.7 | 5.2 | 8.0 | 10.4 |
(1)加热、浸取时所加矿石均需粉碎,其目的是 .
(2)写出FeS和MnO2和稀硫酸反应的离子方程式: .
(3)试剂X的作用是调节溶液的pH以生成Fe(OH)3、Al(OH)3 . pH调节的范围是 , 试剂X可以选用(填选项字母).
A.MnCO3 B.Na2CO3 C.Zn2(OH)2CO3 D.NH3H2O
(4)电解(Ⅴ)中阳极的电极反应式为 .
(5)Zn和MnO2是制作电池的原料.某锌﹣锰碱性电池以KOH溶液为电解质溶液,其电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s).该电池的正极的电极反应式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com