
用铅蓄电池电解AgNO3、Na2SO3的溶液,a、b、c、d电极材料均为石墨,已知铅蓄电池的总反应为:Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是
2PbSO4(s)+2H2O(1)通电时a电极质量增加,下列说法正确的是

A.电路中通过1mol电子时,Y电极质量增加48g
B.放电时铅蓄电池负极的电极反应式为:PbO2(s)+4H+(aq)+SO42-(aq)+2e-===PbSO4(s)+2H2O(l)
C.c、d电极产生气体的物质的量之比为1∶2
D.X极为负 极
极
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:填空题
现有以下物质:①NaHCO3晶体②液态SO3③HF④盐酸⑤蔗糖⑥铜⑦KOH固体⑧氨水。请回答下列问题;
(1)属于非电解质的是________________,
(2)属于电解质的_______________,
(3)属于电解质的依次写出其在水中的电离方程式:______________
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上10月月考化学试卷(解析版) 题型:选择题
已知25℃时有关弱酸的电离平衡常数:
弱酸化学式 | CH3COOH | HCN | H2CO3 |
电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关 系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.a mol·L—1 HCN溶液与b mol·L—1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定小于b
C.冰醋酸中逐滴加水,则溶液的导电性、 醋酸的电离度、pH均先增大后减小
醋酸的电离度、pH均先增大后减小
D.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +2c(CO32-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:实验题
利用如图装置测定中和热的实验步骤如下:

①量取50mL0.25mol/LH2SO4溶液倒入小烧杯中,测量温度;
②量取50mL0.55mol/LNaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。
请回答:
(1)如右图所示,仪器A的名称是_______________;
(2)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃[ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 25.0 | 25.2 | 28.5 | ||
2 | 24.9 | 25.1 | 28.3 | ||
3 | 25.5 | 26.5 | 31.8 | ||
4 | 25.6 | 25.4 | 29.0 | ||
(3)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是_________ (填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(4)已知:CH3COOH(aq)与NaOH(aq)反应的ΔH=-12.1kJ·mol-1;HCl(aq)与NaOH(aq)反应的ΔH=-55.6kJ·mol-1。则C H3COOH在水溶液中电离的ΔH等于_________
H3COOH在水溶液中电离的ΔH等于_________
A.-67.7kJ·mol-1 B.-43.5kJ·mol-1
C.+43.5kJ·mol-1 D.+67.7kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO
2NH3(g)+CO 2(g)。不能判断该分解反应已经达到化学平衡的是
2(g)。不能判断该分解反应已经达到化学平衡的是
A.密闭容器中二氧 化碳的体积分数不变
化碳的体积分数不变
B.密闭容器中混合气体的密度不变
C.密闭容器中气体的总物质的量不变
D. v(NH3)正=2v(CO2)逆
v(NH3)正=2v(CO2)逆
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:填空题
25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mo1)随时间t的变化如图2-10-2所示。已知达平衡后,降低温度,A的转化率将 增大。
增大。

(1)根据图 2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
2-10-2数据,写出该反应的化学方程式________________;此反应的平衡常数表达式K=______________。从反应开始到达第一次平衡时的平均反应速率v(A)为_________。
(2)在5~7min内,若K值不变,则此处曲线变化的原因是________________。
(3)图2-10-3表示此反应的反应速率v和时间t的关系。各阶段的平衡常数如下表所示:
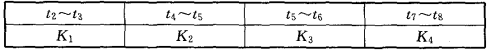
根据图2-10-3判断,在t3和t6时刻改变的外界条件分别是__________和____________;K1、K2、K3、K4之间的关系为__________(用“>”“<”或“=”连接)。平衡时A的转化率最大的一段时间是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- | |
| B. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu | |
| C. | 三氯化铁溶液中加入铁粉:Fe3++Fe=2 Fe2+ | |
| D. | NaHCO3溶液与盐酸反应:HCO3-+H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com