
【题目】(14分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究。
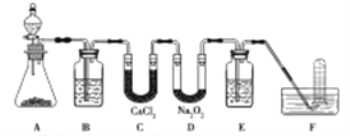
(1)A是实验室制取CO2的装置,其中发生反应的离子方程式是________;装置B的作用是____________。
(2)检验F中气体成分,即能说明过氧化钠可作潜水艇供氧剂,则实验操作的方法及现象是_______________。
(3)查阅有关资料表明:2H2O+2Na2O2=4NaOH+O2↑。某研究小组用同位素标记法对过氧化钠进行标记(![]() ),以探究这一反应的历程:_________________
),以探究这一反应的历程:_________________
①甲同学从电子转移角度得出其离子方程式为:_______________。
②乙同学发现:向Na2O2与水反应后的溶液中加入MnO2,又产生无色能使带火星的木条复燃的气体,从这个角度,写出其反应历程:___________________。
(4)设计并完成过氧化钠样品(已知所含杂质与酸碱均不反应)的纯度测定:
甲、乙两位同学各取了ag样品并分别配制成了100.00mL溶液进行实验,实验操作中甲同学是将样品直接溶于蒸馏水中;而乙同学却是将蒸馏水先加热煮沸,再把蒸馏水分成两份,一份中趁热加入样品溶解,待冷却到室温后再加人另一份水来进行配制。他们分别取出各自配制的溶液20.00mL,加入酚酞数滴后,用浓度为cmol/L的盐酸进行滴定;重复滴定操作2次,甲同学和乙同学分别计算出了所用盐酸的体积平均值,分别为VAmL和VWmL。
①在样品的溶解与配制中,你认为_______(填“甲”、“乙”)同学的操作是合理的,理由是:__________________。
②另一同学的操作将会使实验结果______(填“偏大”、“偏小”或“无影响”)。
③原过氧化钠样品的纯度是___________。
【答案】(1)CaCO3+2H+=Ca2++H2O+CO2↑(2分);除去CO2中混有的HCl(l分)
(2)待试管集满气体后,用大拇指堵住试管口从水槽中取出正立,松开拇指后,将带火星的木条迅速放在试管口,若木条复燃,则说明过氧化钠与二氧化碳反应产生氧气,可作供氧剂(2 分)
(3)①Na218O2+2H2O=4Na++2OH-+18O2↑+218OH-
②2H2O+Na218O2=2NaOH+ H218O2;2H218O2![]() 2H218O+ 18O2↑
2H218O+ 18O2↑
(4)①乙;沸水能使Na2O2溶解时所生成的H2O2迅速分解,消除其对中和滴定(特别是指示剂)的影响;②偏小 ③![]()
【解析】
试题分析:(1)A是实验室制取CO2的装置,其中发生反应的离子方程式是CaCO3+2H+=Ca2++H2O+CO2↑;由于盐酸易挥发,生成的二氧化碳中含有氯化氢气体,因此装置B的作用是除去CO2中混有的HCl。
(2)二氧化碳与过氧化钠反应生成氧气,氧气是助燃性气体,则检验F中气体成分的实验操作的方法及现象是待试管集满气体后,用大拇指堵住试管口从水槽中取出正立,松开拇指后,将带火星的木条迅速放在试管口,若木条复燃,则说明过氧化钠与二氧化碳反应产生氧气,可作供氧剂。
(3)①过氧化钠与水的反应中过氧化钠既是氧化剂,也是还原剂,则从电子转移角度得出其离子方程式为Na218O2+2H2O=4Na++2OH-+18O2↑+218OH-。
②向Na2O2与水反应后的溶液中加入MnO2,又产生无色能使带火星的木条复燃的气体,这说明反应中有双氧水生成,双氧水在二氧化锰的作用下分解生成氧气,其反应历程可表示为2H2O+Na218O2=2NaOH+ H218O2;2H218O2![]() 2H218O+ 18O2↑。
2H218O+ 18O2↑。
(4)①由于沸水能使Na2O2溶解时所生成的H2O2迅速分解,消除了双氧水对中和滴定(特别是指示剂)的影响,所以乙的操作方法正确;
②由于酚酞能够消耗氢氧化钠溶液,则滴定过程中消耗盐酸的体积偏小,测定结果偏小;
③乙的操作合理,若100mL配制的样品溶液完全用该浓度的盐酸中和,消耗盐酸体积应该为:(VWmL×100mL)/ 20mL=5VWmL,消耗氯化氢的物质的量为:cmol/L×5VW×10-3L=5cVW×10-3mol,则样品中含有氢氧化钠的物质的量为:5cVW×10-3mol,过氧化钠的物质的量为:0.5×5cVW×10-3mol=2.5cVW×10-3mol,样品的纯度为:(78g/mol×2.5cVW×10-3mol)/ag×100%=![]() 。
。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】可用自由电子与金属离子的碰撞中有能量传递来解释的物理性质是( )
A.金属是热的良导体
B.金属是电的良导体
C.金属有良好的延展性
D.有金属光泽,不透明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)安对于工农业生产及国防等都具有重要意义。
(1)工业上以CO2和NH3为原料在一定条件下合成尿素的化学方程式为CO2(g)+2NH3(g) ![]() CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
(2)合成氨的原料之一为氢气,以天然气为原料制备氢气的原理如下:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H>0
下列措施一定能使平衡体系中氢气百分含量增大的是______
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.减小压强
(3)T℃时,将1molCO和H2的混合气体与0.2molH2O(g)混合,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
(4)在恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。
CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。

(5)图乙是在一定温度和压强下合成氨反应中H2和N2的起始物质的量之比与NH3平衡体积分数的关系。图中a点的横坐标为______;若按此网站的量之比投料,达到平衡时N2的体积分数为14.5%,则a点的纵坐标为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中属于氧化还原反应的是
A. 食醋不慎洒落到大理石台面出现腐蚀现象
B. 做馒头用的发面中常加入少许碱面(小苏打)揉和
C. 烧菜用过的铁锅,经放置常出现红棕色斑迹
D. 粗盐潮解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、油脂、蛋白质的说法正确的是
A.蔗糖在人体内水解产物只有葡萄糖
B.油脂水解可得到氨基酸和甘油
C.淀粉和纤维素水解最终产物都是葡萄糖
D.鉴别部分蛋白质可利用浓硫酸与蛋白质的颜色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质转化关系如图所示,气体B为红棕色,C常温时为无色液体,相对分子质量D比B大17,E的原子序数为12。
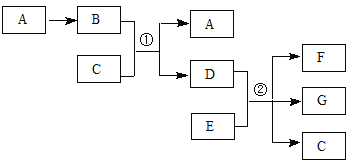
回答下列问题:
(1)A的化学式是 ,C分子的电子式是 。
(2)反应①的离子方程式是 ;若n(E)∶n(D)=2∶5,反应②的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8 kJmol-1、-283.0 kJmol-1和-726.5 kJmol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
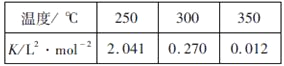
①由表中数据判断△H_______0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为________,则反应速率v(H2)=__________。
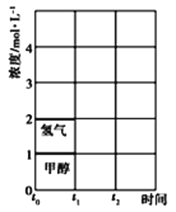
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用乙二醇、铜或铜的化合物制备乙二醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
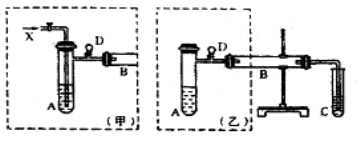
(1)两套装置中的A、B处都需加热,A处用水浴加热,A处用水浴加热的主要优点是 。
(2)若按甲装置进行实验,B管处装铜粉,通入A管的气体为X,B中反应的化学方程式为 。
(3)若按乙装置进行实验,则B管中应装 ,B中反应的化学方程式为 。
(4)实验完成时先打开D处的铁夹,再撤去酒精灯,这样做的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,回答下列问题:
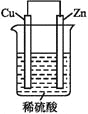
(1)正极发生____反应(选填“氧化”或“还原”),负极电极反应式为:____。
(2)电子流动方向,从____电极(选填“Cu”或“Zn”),经外电路,流向另一电极。阳离子向____电极定向移动(选填“Cu”或“Zn”)。
(3)有0.1 mol电子流过导线,则产生H2在标准状况下的体积为____,若是断开Zn和Cu之间的导线,产生气泡的速度____(选填“加快”、“不变”或“减慢”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com