
【题目】今有Ba(NO3)2、AgNO3、Fe(NO3)3的混合液,欲将Ba2+、Ag+、Fe3+分离,分别得到三种元素的不溶物,按如图所示实验:
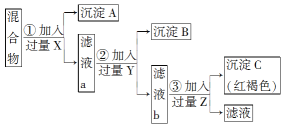
(1)加入的试剂(写化学式):X________,Y________,Z________。
生成的沉淀(写化学式):A________,B________,C________。
(2)写出反应①②③的离子方程式:
①_____________________________________________________________,
②_____________________________________________________________,
③_____________________________________________________________。
【答案】HCl(或NaCl)H2SO4(或Na2SO4)NaOHAgClBaSO4Fe(OH)3Ag++Cl-===AgCl↓Ba2++SO42-===BaSO4↓Fe3++3OH-===Fe(OH)3↓
【解析】
依据物质溶解度和流程可知,先加入盐酸或氯化钠溶液A沉淀银离子,过滤后加入硫酸盐溶液或稀硫酸沉淀钡离子,最后加入强碱沉淀铁离子,据此解答。
(1)沉淀钡离子一般用硫酸根离子,沉淀银离子一般用氯离子,沉淀铁离子一般用氢氧根离子,由于硫酸银微溶于水,所以首先沉淀银离子,即X是HCl(或NaCl),根据流程图可知最后得到红褐色沉淀,则Y是H2SO4(或Na2SO4),用来沉淀钡离子,Z是NaOH,用来沉淀铁离子,即A是AgCl,B是BaSO4,C是Fe(OH)3。
(2)根据以上分析可知反应①②③的离子方程式分别是Ag++Cl-=AgCl↓、Ba2++SO42-=BaSO4↓、Fe3++3OH-=Fe(OH)3↓。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组在相同条件下,将10.00g下列物质分别置于相同规格的烧杯,并敞口存放于空气中,烧杯中物质质量随时间变化如下表,回答下列问题。
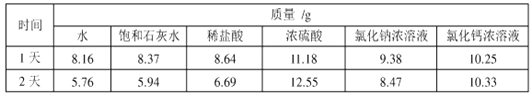
(1)下列图示能反映水在空气中放置时发生变化的微观示意图是_________(填字母序号)。
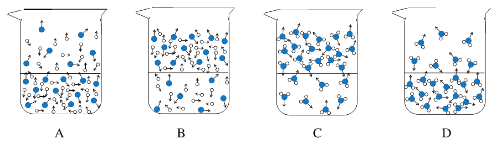
图中![]() 表示氧原子,
表示氧原子,![]() 表示氢原子)
表示氢原子)
(2)石灰水在空气中久置后有浑浊现象,写出该反应的化学方程式___________________。
(3)为研制一种安全、环保的除湿剂,可选择上表中的__________________(填溶质的化学式)。
(4)将10.00g氯化钠浓溶液敞口久置后,最终得到2.26g晶体(已知该温度下氯化钠溶解度为36.1g),则该溶液是________(填“饱和”或“不饱和”)溶液。
(5)为进一步研究稀盐酸敞口久置后浓度变化,该小组开展如下探究。
①甲同学猜想浓度可能会变大,理由是_______________________。
②为验证甲同学的猜想是否正确,设计实验方案:_________________________。
(6)乙同学取20%的氢氧化钠溶液20.00g,敞口放置一段时间后部分变质,得到18.80g溶液,_________(填“能”或“不能”)计算所得溶液中溶质组成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向甲、乙两个容积均为1 L的恒容容器中。现向甲中充入2 mol A、2 mol B,乙中充入1 mol A、1 mol B。相同温度下发生反应:A(g)+B(g) ![]() xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示。下列说法正确的是 ( )
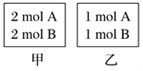
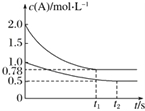
A. x不可能等于1
B. 甲、乙两容器中反应达平衡时,平衡常数K甲<K乙
C. 将乙容器升温可使甲、乙容器内各物质的体积分数相同
D. 若向甲容器中再充入2 mol A、2 mol B,则平衡时甲中0.78 mol·L-1<c(A)<1.56 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CrO42-+2H+![]() Cr2O72-+H2O。25℃时,调节初始浓度为1.0mol·L-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如下曲线。下列说法不正确的是( )
Cr2O72-+H2O。25℃时,调节初始浓度为1.0mol·L-1的Na2CrO4溶液的pH,测定平衡时溶液中c(Cr2O72-)和c(H+),获得如下曲线。下列说法不正确的是( )
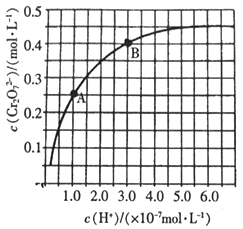
A. 平衡时,pH越小,c(Cr2O72-)越大
B. A、B两点c(CrO42-)之比为5:2
C. B点CrO42-的平衡转化率为40%
D. 平衡时,若溶液中c(CrO42-)=2c(Cr2O72-),则c(H+)=1.0×10-7mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2 L的密闭容器中发生反应:N2O4(g)![]() 2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
2NO2(g) ΔH>0,反应过程中各物质的物质的量浓度(c)随时间(t)的变化曲线如图所示。
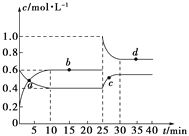
(1)该温度下,该反应的平衡常数为___________,若温度升高,K值将________(填“增大”、“减小”或“不变”)。
(2)a、b、c、d四个点中,表示化学反应处于平衡状态的是________点。从起点开始首次达到平衡时,以NO2表示的反应速率为________。
(3)25 min时,加入了________(填加入物质的化学式及加入的物质的量),使平衡发生了移动。
(4)d点对应NO2的物质的量浓度_______(填“大于”、“小于”或“等于”)0.8 mol·L-1,理由是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下表中所列键能数据,判断下列分子中,最不稳定的分子是( )
化学键 | H—H | H—Cl | H—I | Cl—Cl | Br—Br |
键能/kJ/mol | 436 | 431 | 299 | 247 | 193 |
A.HClB.HBrC.H2D.Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨、磷属于同一主族元素,是组成生命体的重要元素,其单质及化合物用途广泛。回答下列问题:
(1)基态P原子的核外电子排布式为_____,磷及其同周期相邻元素第一电离能由大到小的顺序是______________________。
(2)NH3比PH3易液化的原因是______________________。
(3)自然固氨现象发生的一系列化学变化:N2→NO→NO2→HNO3→NO3-解释了民谚“雷雨发庄稼”的原理。
①N2分子结构中。σ键和π键之比为_________,己知N![]() N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
N的键能为946kJ·mol-1,远大于N—N的键能(193 kJ·mol-1)的三倍,原因是______________________。
②NO3-中N原子采取___________杂化方式,其空间构型为__________,写出它的一种等电子体的化学式_____________________。
③已知酸性:HNO3>HNO2,下列相关见解合理的是_________________。
A.含氧酸中氧原子总数越多,酸性越强
B.同种元素化合价越高,对应含氧酸的酸性越强
C.HNO3中氮元素的正电性更高,在水溶液中更易电离出H+,酸性强于HNO2
(4)磷化硬(BP)是一种超硬耐磨涂层材料,其晶胞结构如图所示,图中a点和b点的原子坐标参数依次为(0,0,0)、(![]() ,
, ![]() ,
, ![]() ),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。
),则c 点的原子坐标参数为_______。已知该晶体密度为ρg·cm-3,则B-P键的键长为_____pm (阿伏加德罗常数用NA表示,列出计算式即可)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com