

| A.X的气态氢化物与Q的气态氢化物相遇会产生白烟 |
| B.元素的非金属性:Y>Q,同浓度的氢化物水溶液的酸性:HY<HQ |
| C.形成简单离子的半径从小到大的顺序是:Y- <Q- <W2- |
| D.Z的最高价氧化物可溶于水,也能溶于强碱溶液 |
科目:高中化学 来源:不详 题型:填空题
| A.NH5中既有离子键又有共价键 |
| B.NH5的熔、沸点高于NH3 |
| C.NH5固体投入少量水中,可产生两种气体 |
| D.0.1 mol NH5中含有5 mol N—H键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子核内中子的总质量小于质子的总质量 |
| B.该原子的质量数等于m-n |
| C.该元素的相对原子质量近似等于m+n |
| D.该原子的相对原子质量近似等于m+n |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH3+H2O→NH3·H2O | B.Br2+H2→2HBr |
| C.H2+I2→2HI | D.HClO→H++ClO- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.若M+和R2-的核外电子层结构相同,则原子序数R>M |
| D.主族元素的最高正化合价等于该元素原子的最外层电子数 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
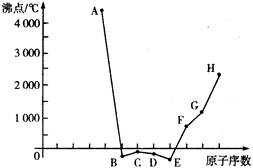
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | A | B | D | E | G | H | I | J |
| 化合价 | –1 | –2 | +4、–4 | +7、–1 | +5、–3 | +3 | +2 | +1 |
| 原子半径/nm | 0.071 | 0.074 | 0.077 | 0.099 | 0.110 | 0.143 | 0.160 | 0.186 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.R的氧化物都能溶于水 | B.R的最高价氧化物对应的水化物都是H2RO3 |
| C.R都是非金属元素 | D.R的氧化物都能与NaOH反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.3He和3H互为同位素 | B.3He原子核内质子数为3 |
| C.3He原子核内中子数为1 | D.3He原子易失去两个电子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com