
分析 (1)发生反应:2Na+2H2O=2NaOH+H2↑,根据方程式中对比关系计算生成氢气体积;
(2)氢气的总体积减去钠与水反应生成氢气的体积就是铝与氢氧化钠反应生成的氢气体积,根据方程式恒计算NaAlO2物质的量、Al反应消耗NaOH物质的量,进而计算溶液中NaOH的物质的量浓度.
解答 解:(1)设生成氢气的体积为V,则:
2Na+2H2O=2NaOH+H2↑
46g 22.4L
1.15g V
V=$\frac{22.4L×1.15g}{46g}$=0.56L
故答案为:0.56L;
(2)1.15g Na的物质的量为$\frac{1.15g}{23g/mol}$=0.05mol,
Na反应生成氢气物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,
则Al反应生成氢气为0.055mol-0.025mol=0.03mol,
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 2mol 3mol
0.02 0.02mol 0.03mol
所以剩余氢氧化钠0.05mol-0.02mo=0.03mol,故氢氧化钠的物质的量浓度=$\frac{0.03mol}{0.05L}$=0.6mol/L
答:混合溶液中NaOH的物质的量浓度为0.6mol/L.
点评 本题考查混合物有关计算,注意氢气来源于钠与水反应及铝和氢氧化钠反应,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol H2O的体积约为22.4 L | |
| B. | 1 mol气体的体积若是22.4 L,它必定处于标准状况 | |
| C. | 20℃、101 kPa时1mol HCl所占的体积约为22.4 L | |
| D. | 标准状况下,1 mol H2和O2的混合气体的体积约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ②③ | C. | ①④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | - | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | - | -2 | - | -4 | -3 | -1 | - | -3 | -4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
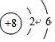 ;氮元素通常转化为化肥铵盐,铵根离子的电子式为
;氮元素通常转化为化肥铵盐,铵根离子的电子式为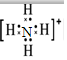 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
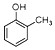 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )| A. | 4类 | B. | 5类 | C. | 6类 | D. | 8类 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com