
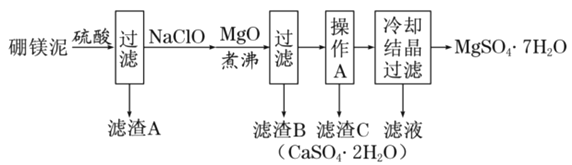
【题目】硼镁泥是硼镁矿生产硼砂晶体![]() 时的废渣,其主要成分是MgO,还含有
时的废渣,其主要成分是MgO,还含有![]() 、CaO、
、CaO、![]() 、FeO、MnO、
、FeO、MnO、![]() 等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
等杂质。以硼镁泥为原料制取七水硫酸镁的工艺流程如下:
回答下列问题:
(1)![]() 中B的化合价为__________。
中B的化合价为__________。
(2)![]() 易溶于水,也易发生水解:
易溶于水,也易发生水解:![]() 硼酸
硼酸![]() 硼酸在常温下溶解度较小
硼酸在常温下溶解度较小![]() 。写出加入硫酸时
。写出加入硫酸时![]() 发生反应的化学方程式:_____。
发生反应的化学方程式:_____。
(3)滤渣B中含有不溶于稀盐酸但能溶于热浓盐酸的黑色固体,写出生成黑色固体的离子方程式____________。
(4)加入MgO的目的是___________________。
(5)已知![]() 、
、![]() 的溶解度如下表:
的溶解度如下表:
温度 | 40 | 50 | 60 | 70 |
|
|
|
|
|
|
|
|
|
|
“操作A”是将![]() 和
和![]() 混合溶液中的
混合溶液中的![]() 除去,根据上表数据,简要说明“操作A”步骤为____________________。
除去,根据上表数据,简要说明“操作A”步骤为____________________。
(6)硼砂也能在工业上制取![]() ,
,![]() 被称为有机化学中的“万能还原剂”。
被称为有机化学中的“万能还原剂”。
![]() 写出
写出![]() 的电子式:___________。
的电子式:___________。
![]() “有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克
“有效氢含量”可用来衡量含氢还原剂的还原能力,其定义是:每克含氢还原剂的还原能力相当于多少克![]() 的还原能力。
的还原能力。![]() 的有效氢含量为_________
的有效氢含量为_________![]() 保留两位小数
保留两位小数![]() 。
。
![]() 在碱性条件下,在阴极上电解
在碱性条件下,在阴极上电解![]() 也可制得硼氢化钠,写出阴极室的电极反应式:________。
也可制得硼氢化钠,写出阴极室的电极反应式:________。
【答案】+3; Na2B4O7+H2SO4+5H2O═Na2SO4+4H3BO3↓ ClO+Mn2++H2O═MnO2+Cl+2H+ 调节溶液的pH值,使![]() 转化为氢氧化铁沉淀除去; 蒸发浓缩、趁热过滤;
转化为氢氧化铁沉淀除去; 蒸发浓缩、趁热过滤;  0.21 BO2+6H2O+8e═BH4+8OH
0.21 BO2+6H2O+8e═BH4+8OH
【解析】
分析流程,硼镁泥中主要有MgO,还含有Na2B4O7、CaO、Fe2O3、FeO、MnO、SiO2等杂质,通过硫酸酸浸,得到滤渣为SiO2,滤液中含有Na+,Ca2+,Fe2+,Fe3+,Mn2+,H+,SO42-,B4O72-,经过NaClO溶液处理,NaClO在酸性溶液中具有一定的氧化性,将Fe2+氧化为Fe3+,将Mn2+氧化为MnO2,加入MgO处理,形成Fe(OH)3和MnO2,这就是滤渣B,滤液经过蒸发浓缩,趁热过滤,得到滤渣C为CaSO42H2O,此时滤液中存在Na+,B4O72-,SO42-,Mg2+,滤液经过冷却结晶,得到MgSO47H2O和硼砂溶液,据此分析;
(1)根据物质呈电中性原理,计算B的化合价;
(2)硼砂水解产生H3BO3,H3BO3是弱酸,在硼砂溶液中加入硫酸,可以制得H3BO3,据此写出反应的化学方程式;
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,根据流程分析,应为MnO2,由NaClO在酸性溶液中氧化Mn2+得到,据此写出反应的离子方程式;
(4)加入MgO,使溶液中Fe3+产生Fe(OH)3沉淀,除去Fe3+,据此分析加入MgO的作用;
(5)操作“A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据溶解性数据的分析操作A的步骤;
(6)①NaBH4的电子式,存在Na+和BH4-,据此写出电子式;
②根据有效含氢量的定义,每克含氢还原剂的还原能力相当于多少克H2的还原能力,H2做还原剂,1molH2失去电子2mol,结合电子得失守恒计算;
③碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,阴极处发生的反应为物质得到电子,发生还原反应,考虑到溶液为碱性,OH-参加反应或反应生成OH-,据此写出电极反应式。
(1)根据物质呈电中性原理,Na2B4O710H2O中Na为+1价,O为2价,则B的化合价为![]() =+3;
=+3;
(2)硼砂水解产生H3BO3,H3BO3是弱酸,在硼砂溶液中加入硫酸,可以制得H3BO3,则加入硫酸时Na2B4O7发生反应的化学方程式为:Na2B4O7+H2SO4+5H2O═Na2SO4+4H3BO3;
(3)滤渣B中含有不溶于稀盐酸但能溶于浓盐酸的黑色固体,根据流程分析,应为MnO2,由NaClO在酸性溶液中氧化Mn2+得到,考虑到介质为酸性,H+参与反应或反应生成H+,则生成黑色固体的离子方程式为:ClO+Mn2++H2O═MnO2+Cl+2H+;
(4)加入MgO,使溶液中Fe3+产生Fe(OH)3沉淀,除去Fe3+,则加入MgO的目的是:调节溶液的pH值,使Fe3+转化为Fe(OH)3除去,;
(5)操作“A”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据溶解性的数据分析,随着温度的升高,MgSO4的溶解度增加,CaSO4的溶解度降低,可见随着温度升高,二者溶解度差别增大,因此可考虑操作A中对溶液蒸发浓缩,可以析出大量的CaSO4固体,在温度高时,进行趁热过滤可以达到分离的目的;
(6)①NaBH4的电子式,存在Na+和BH4,则NaBH/span>4的电子式为: ;
;
②根据有效含氢量的定义,每克含氢还原剂的还原能力相当于多少克H2的还原能力,H2做还原剂,1molH2失去电子2mol,1gH2的物质的量为![]() =0.5mol,0.5molH2转移的电子数为1mol,根据电子得失守恒,NaBH4也应转移1mol电子,NaBH4中H为1价,做还原剂时,H从1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,则转移1mol电子消耗NaBH4的物质的量为0.125mol,其质量为0.125mol×38g/mol=4.75g,即1gH2相当于4.75gNaBH4,那么1gNaBH4相当于
=0.5mol,0.5molH2转移的电子数为1mol,根据电子得失守恒,NaBH4也应转移1mol电子,NaBH4中H为1价,做还原剂时,H从1价升高为+1价,1molNaBH4转移电子数为4×2=8mol,则转移1mol电子消耗NaBH4的物质的量为0.125mol,其质量为0.125mol×38g/mol=4.75g,即1gH2相当于4.75gNaBH4,那么1gNaBH4相当于![]() gH2,即0.21gH2;
gH2,即0.21gH2;
③碱性条件下,在阴极上电解NaBO2也可制得硼氢化钠,阴极处发生的反应为物质得到电子,发生还原反应,考虑到溶液为碱性,OH参加反应或反应生成OH,则阴极室的电极反应式为:BO2+6H2O+8e═BH4+8OH。


科目:高中化学 来源: 题型:
【题目】工业用强氧化剂PbO2来制备KClO4的工业流程如下:
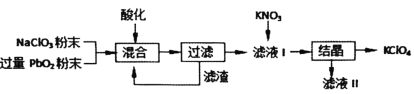
根据流程推测,下列判断不正确的是( )
A.“酸化”的试剂是稀硝酸或浓盐酸
B.“滤渣”主要成分是PbO2粉末,可循环使用
C.NaClO3与PbO2反应的离子方程式为![]()
D.在KNO3、KClO4、NaClO4、NaNO3中,常温下溶解度小的是KClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中字母分别表示一种元素。请回答下列问题:
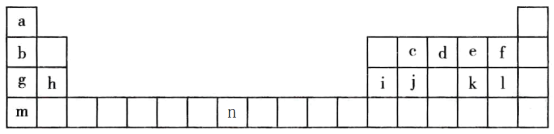
(1)a的三种核素分别为______、______、______。(用汉字表示)
(2)j是一种良好的____________材料,写出元素j的氧化物的一种用途____________。
(3)a、d、f、g四种元素的原子半径由小到大的顺序为________(用元素名称表示)。
(4)c、d、j、l四种元素最高价氧化物对应的水化物的酸性由强到弱的顺序为______(用化学式表示)。
(5)上述元素形成的氢化物中最稳定的是_____,溶于水显碱性的是_____。
(6)e、k 两种元素得电子能力强的是_____ (用元素符号表示)
(7)元素g、e 形成的原子个数1:1的化合物的化学式为_____,阴阳离子个数比为为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳是地球上组成生命的最基本的元素之一,是形成单质及其化合物种类最多的元素。
(1)碳原子核外有________种不同空间运动状态的电子。
(2)碳元素能形成多种无机物。
①CO![]() 的立体构型是______________与其互为等电子体的阴离子_________________。
的立体构型是______________与其互为等电子体的阴离子_________________。
②MgCO3分解温度比CaCO3低的原因是_________________________。
(3)碳能与氢、氮、氧三种元素构成化合物CO(NH2)2,该分子中各元素的电负性由大到小的顺序为________,其中C原子的杂化方式为_______,该物质易溶于水的主要原因是________________。
(4)CO是碳元素的常见氧化物,与N2互为等电子体,则CO的结构式为________
(5)图为碳的另一种同素异形体金刚石的晶胞,其中原子坐标参数为A(0,0,0),B![]() ,C
,C![]() ;则D原子的坐标参数为________。
;则D原子的坐标参数为________。
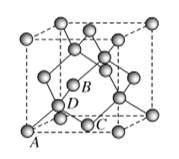
(6)立方氮化硼晶体的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5 pm。立方氮化硼的密度是________ g·cm-3(列出计算式即可,阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,反应原理为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
2NH3(g) ΔH=-92.4 kJ·mol-1。一种工业合成氨的简式流程图如下:
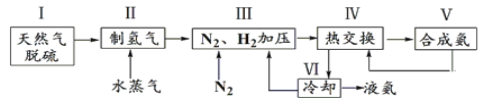
(1)①步骤Ⅱ中制氢气的原理如下:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g);K1
CO(g)+3H2(g);K1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g);K2
CO2(g)+H2(g);K2
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g);K=___________(用含K1、K2的代数式表示)。
CO2(g)+4H2(g);K=___________(用含K1、K2的代数式表示)。
②T1温度时,对于反应:CO(g)+ H2O(g)![]() CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
CO2(g)+ H2(g),向2 L的恒容密闭容器中通入一定量的CO和H2O(g)。若达到平衡后,反应放热Q kJ,保持其他条件不变,只是向原平衡体系中再通入0.20 mol H2O(g),则下列说法正确的是_____________。
a.CO的转化率将增大 b.达到新平衡时的反应热ΔH > —Q
c.气体的密度将不变 d.H2O的体积分数增大
(2)将3 molH2和2 molN2充入某恒温恒压容器中,发生合成氨的反应:3H2(g) +N2(g) ![]() 2NH3(g),达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
2NH3(g),达平衡时NH3的浓度为c mol·L-1。保持温度不变,按下列配比分别充入该容器,平衡后NH3的浓度不为c mol·L-1的是_________。
a.6 molH2 + 4 molN2
b.0.75 molH2 + 0.75 molN2 + 0.5 molNH3
c.3 molH2+ 1 molN2 + 2 mol NH3
(3)H2O2作为氧化剂在反应时不产生污染物被称为绿色氧化剂,因而受到人们越来越多的关注。为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答下列问题:
①定性图甲可通过观察产生气泡的快慢的定性分析比较得出结论。有同学提出将FeCl3溶液改为Fe2(SO4)3溶液,你认为___________,(填合理或不合理)
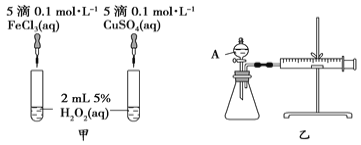
②定量如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。检查该装置气密性的方法是:关闭A的活塞,将注射器活塞向外拉出一段后松手,过一段时间后看__________,实验中需要测量的数据是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为合成1-丁醇,查阅资料得知下列合成路线:CH3CH=CH2+CO+H2![]() CH3CH2CH2CHO
CH3CH2CH2CHO ![]() CH3CH2CH2OH;CO的制备原理:HCOOH
CH3CH2CH2OH;CO的制备原理:HCOOH![]() CO↑+H2O,并设计出原料气的制备装置如图所示。
CO↑+H2O,并设计出原料气的制备装置如图所示。
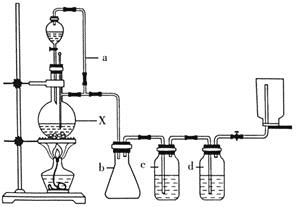
请填写下列空白:
(1)若用以上装置制备干燥纯净的CO,仪器X的名称是________;装置中b的作用是________;c和d中盛装的试剂分别是________,________。
(2)实验室现有浓硫酸、2-丙醇,请写出制备丙烯的化学方程式:________________________。
(3)制丙烯时,还产生少量SO2、CO2及水蒸气,该小组用以下试剂检验这四种气体,混合气体通过试剂的顺序是________(填序号)。
①饱和Na2SO3溶液 ②酸性KMnO4溶液 ③石灰水 ④无水CuSO4 ⑤品红溶液
(4)正丁醛经催化剂加氢得到含少量正丁醛的1-丁醇粗品,为纯化1-丁醇,该小组查阅文献得知:①R-CHO+NaHSO3(饱和)→RCH(OH)SO3Na↓;②沸点:乙醚34℃,1-丁醇118℃,并设计出如下提纯路线:

试剂1为________,操作2为________,操作3为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物F的合成路线图如下:
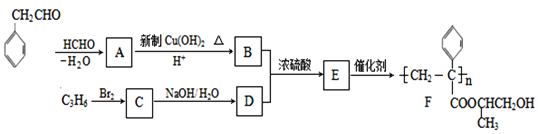
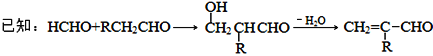
请据此回答:
(1)A中含氧官能团名称是_______,C的系统命名为_________。
(2)检验B中所含官能团所用的试剂有______;E→F的反应类型是___________。
(3)C生成D的反应化学方程式为_____________________________,如果C与NaOH的醇溶液反应,则生成的有机物的结构简式为________(同一个碳原子上连两个碳碳双键的除外)。
(4)G物质与![]() 互为同系物,且G物质的相对分子质量比
互为同系物,且G物质的相对分子质量比![]() 大14的,则符合下列条件的G的同分异构体有____种。
大14的,则符合下列条件的G的同分异构体有____种。
① 分子中含有苯环,且苯环上有两个取代基 ② 遇氯化铁溶液变紫色
③ 能与溴水发生加成反应
(5) 参照上述合成路线,设计一条由甲醛、乙醛和甲醇为主要原料制备 ![]() 的合成路线__________________。
的合成路线__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知无水AlCl3遇潮湿空气即产生大量白雾,实验室可用如图所示装置制备AlCl3。
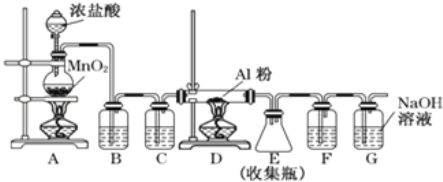
(1)装置A中发生反应的离子方程式为________________________________________
(2)装置B盛放的试剂是______,其作用是_______________________________;装置C盛放的试剂是__________,其作用是__________________________________
(3)装置G的作用是________________,G中发生反应的化学方程式是________________________________________
(4)F中盛放的试剂是______,其作用是___________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com