
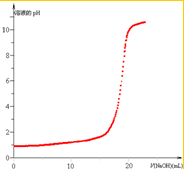
 在20.0mL 0.10mol?L-1的盐酸溶液中滴加0.10mol?L-1 NaOH溶液,并以酚酞为指示剂.
在20.0mL 0.10mol?L-1的盐酸溶液中滴加0.10mol?L-1 NaOH溶液,并以酚酞为指示剂.| ①V(NaOH)(mL) | 0.00 | 18.00 | 19.80 | 19.96 | 19.98 | 20.00 | 20.02 | 20.04 | 20.20 |
| ②溶液的pH | 1.0 | 2.3 | 3.3 | 4.3 | 7 | 9.7 | 10.7 |
| 0.1mol/L×0.020L-0.10mol/L×0.01996L |
| 0.02L+0.01996L |
| 0.1mol/L×0.0204L-0.10mol/L×0.020L |
| 0.0204L+0.020L |
 ,
, ;
;| 1 |
| 6 |
| 5.0×10-6mol×127×103mg/mol |
| w×10-3kg |
| 635mg |
| w |
| 635 |
| w |


科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol?L-1) | NaOH物质的量浓度(mol?L-1) | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.2 | 0.1 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
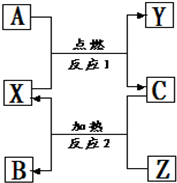 A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:
A、B、C是中学化学常见的单质,X、Y、Z是中学化学常见的氧化物,它们之间有如右图所示的转化关系,请据图回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| A、2d | B、10d |
| C、5d | D、0.8d |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,32克氧气中原子个数为NA |
| B、标准状况下,1mol H2O的体积为22.4L |
| C、常温常压下,1mol H2的质量为2克 |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有的Cl-数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质组 | 不属于同类的物质 | 理由 |
| (1)Mg、O2、N2、NO | ||
| (2)NaOH、Na2CO3、CH4、KCl | ||
| (3)H2CO3、H2SO4、NH3?H2O、H2SiO3 | ||
| (4)CaO、SO2、CO2、SiO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com