
城市的环境污染是当前突出的环境问题。如图A所示,X河流经某工业城市Y,其中a处在上游,附近有丰富的黄铁矿资源;d处在下游,附近有多个企业以硫酸为原料。根据某月Y市环保局监测站对X河水质检测的结果,绘制成简图如图B所示。下列说法不正确的是( )
| A.造成X河污染的主要污染源最可能分布在bc段 |
| B.工业生活污水、固体废弃物等可能是造成X河污染的污染源 |
| C.d处污染程度减小,可能是某些污染物的离子间发生反应生成沉淀所致 |
| D.该城市建设硫酸厂时,综合考虑诸多因素选址在b处最合理 |
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案科目:高中化学 来源: 题型:填空题
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下: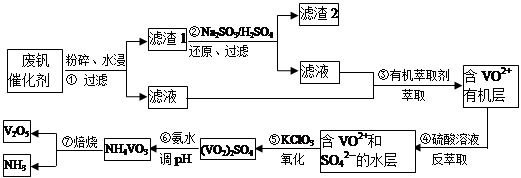
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) 2VO2++H2C2O4+2H+ = 2VO2+ + 2CO2↑+ 2H2O
回答下列问题:
(1)步骤①前,粉碎的目的是_________________________。
(2)步骤②中发生反应的离子方程式为__________________________。
(3)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层) VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是_____________。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.0mL,由此可知(VO2)2SO4溶液钒元素的含量为_________g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: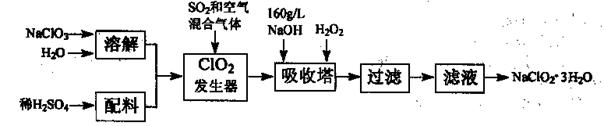
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2—3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
(1)发生器中鼓入空气的作用可能是 。
(2)吸收塔内发生反应的化学方程式为 。
吸收塔内的温度不宜过高,否则会发生反应,其方程式为: 。
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是__ __。
(4)ClO2和氯气均能将电镀废水中的CN—氧化为无毒物质,自身被还原为Cl—,处理含CN一相同量的电镀废水所需氯气的物质的量是ClO2的 倍。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上用闪锌矿(主要成分为ZnS,还含有CdS、Fe2O3等杂质)为原料生产ZnSO4·7H2O的工艺流程如下:(己知Cd的金属活动性介于Zn和Fe之间)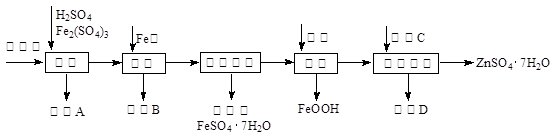
(1)从滤渣A中可获得一种淡黄色非金属单质的副产品,其化学式为 。
(2)浸取过程中Fe2(SO4)3的作用是 ,浸取时Fe2(SO4)3与ZnS发生反应的化学方程式为 。
(3)除铁过程控制溶液的pH在5.4左右,该反应的离子方程式为 。该过程在空气入口处设计了一个类似淋浴喷头的装置,其目的是 。
(4)置换法除重金属离子是Cd2+,所用物质C为 。
(5)硫酸锌的溶解度与温度之间的关系如下表:
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
乙二酸(H2C2O4)是一种重要的化工产品,可以使酸性高锰酸钾溶液褪色,其制备工艺流程如下:
氧化时控制反应液温度为55~60℃,边搅拌边缓慢滴加浓HNO3、H2SO4混合液,可发生下列反应:
C6H12O6+18HNO3→3H2C2O4+18NO2↑+12H2O
C6H12O6+6HNO3→3H2C2O4+6NO↑+6H2O
(1)检验氧化后的溶液中是否仍含有葡萄糖的实验方案为 。
(2)氧化时控制反应液温度为55~60℃的原因是 。
(3)若水解时淀粉利用率为80%,氧化时葡萄糖的利用率为80%,结晶时有10%的乙二酸遗留在溶液中。则30 kg淀粉可生产乙二酸的质量为 。
(4)生产中产生的NOx用氧气和水吸收后产生硝酸循环利用,若尾气NOx中n(NO2)︰n(NO)=2︰1,且NOx的吸收转化率为90%。计算:理论上,每生产9 kg乙二酸至少需要补充质量分数为63%的硝酸溶液多少千克。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
(1)下列化肥属于氮肥的是__________。
| A.NH4Cl | B.KCl | C.(NH4)2SO4 | D.K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列化学工业有关设备、原料、反应条件配套的是
| A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30℃-35℃的氨化饱和食盐水吸收CO2 |
| B.接触法制硫酸:氧化炉、硫铁矿、V2O5、4000-5000 ℃ |
| C.合成氨:沸腾炉、焦炭、铁触媒、5000℃ |
| D.氨氧化法制硝酸:合成塔、空气、铂铑合金、8000℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列工业生产中,各物质的物质的量间的关系式不正确的是( )
| A.制漂白粉:2Cl2~Ca(ClO)2 |
| B.制H2SO4:FeS2~2H2SO4 |
| C.合成氨:C~H2~2/3NH3 |
| D.制HNO3:NH3~HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化学工业是国民经济的支柱产业。下列生产过程中不涉及化学变化的是( )
| A.氮肥厂用氢气和氮气合成氨 |
| B.钢铁厂用热还原法冶炼铁 |
| C.硫酸厂用接触法生产硫酸 |
| D.炼油厂用分馏法生产汽油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com