
| 溶液Y中铝元素的存在形式 | 溶液X中 | ||
| 一定存在的离子 | 一定不存在的离子 | 不能确定的离子 | |
| Al3+ | |||
| Cl- | |||
| 溶液Y中铝元素的存在形式 | 溶液X中 | ||
| 一定存在的离子 | 一定不存在的离子 | 不能确定的离子 | |
| Al3+ | H+、Cl- | CO32-、SO32-、OH-、Ag+ | Mg2+、Cu2+、Ba2+ |
| AlO2- | Ba2+、OH- | Mg2+、Cu2+、H+、Ag+、SO32-、CO32- | Cl- |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
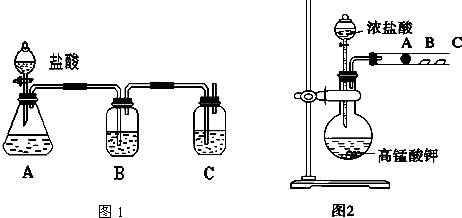
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:
某兴趣小组同学进行乙醛的银镜反应实验的操作步骤如下:| 实验变量 实验序号 | 银氨溶液的量/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
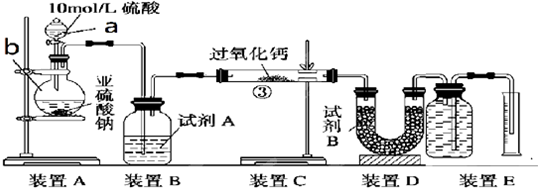
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该烷烃的物质的量为(b-a)mol |
| B、该烷烃的物质的量为a mol |
| C、该烷烃的物质的量为(b-a)/2 mol |
| D、不能求出该烷烃的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
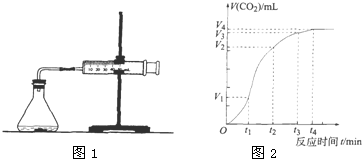
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com