
由二氧化碳、氢气、一氧化碳组成的混合气体在同温、同压下与氮气的密度相同。则该混合气体中二氧化碳、氢气、一氧化碳的体积比为
A.29∶8∶13 B.22∶1∶14 C.13∶8∶13 D.26∶16∶13
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]()
②CO(g)+H2O(g)=CO2(g)+H2(g) ![]()
写出由二氧化碳、氢气制备甲醇的热化学方程式 ;
(2)在压强0.1MPa条件下,容积为 VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。

①P1 P2(填大于、小于或等于);
②在其它条件不变的情况下,再增加 amolCO与2amolH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”,下 同),平衡常数 。
(3)以甲醇为燃料的新型燃料电池,正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:CH3OH+H2O-6e-=CO2+6H+
①正极的电极反应式是 ;放电时,H+移向电池的 (填“正”或“负”)极。
②若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到标准状况下的气体1.12L(不考虑气体的溶解)时,所得溶液的pH= (假设反应前后溶液体积不变)。
查看答案和解析>>
科目:高中化学 来源:2013届山东省潍坊市高三3月第一次模拟考试化学试卷(带解析) 题型:填空题
甲醇( )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。
(1)利用工业废气中的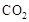 可制取甲醇,其反应为:
可制取甲醇,其反应为: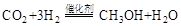
常温常压下已知下列反应的能量变化如图所示:
写出由二氧化碳和氢气制备甲醇的热化学方程式:
。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了 的
的  晶体,在高温下它能传导
晶体,在高温下它能传导 离子。电池工作时正极反应为 。
离子。电池工作时正极反应为 。
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。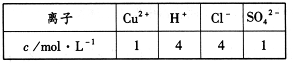
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为 mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将 氧化成
氧化成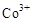 ,然后以
,然后以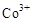 做氧化剂把水中的甲醇氧化成
做氧化剂把水中的甲醇氧化成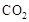 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为: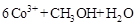
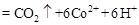 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L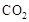 时,共转移电子 mol。
时,共转移电子 mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年河南省开封市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
能源问题是人类社会面临的重大课题,甲醇是一种可再生能源,具有开发和应用的广阔前景,研究甲醇具有重要意义。
(1)用CO合成甲醇的反应为:CO(g)+2H2(g)
 CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。
CH3OH(g)在容积为1L。的密闭容器中分别充入1molCO和2molH2,实验测得甲醇的物质的量和温度、时间的关系曲线如图所示。则该正反应的△H_______0(填“<”、“>”或“=”),判断的理由是______。

(2)利用工业废气中的CO2可制取甲醇,其反应为:CO2+3H2 CH3OH+H2O。
CH3OH+H2O。
①常温常压下已知下列反应的能量变化如下图所示:

由二氧化碳和氢气制备甲醇的热化学方程式为_______。
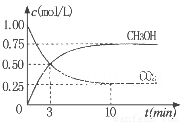
②为探究用CO2生产燃料甲醇的反应原理,现进行如下实验:在一恒温恒容密闭容器中,充入1molCO2 和3molH2,进行上述反应。测得CO2。和CH3OH(g)的浓度随时间变化如图所示。从反应开始到平衡,v(H2)=_______ ;该温度下的平衡常数数值K=______。能使平衡体系中n(CH3OH)/n(CO2))增大的措施有_______(任写一条)。
(3)工业上利用甲醇制备氢气的常用方法有两种。
①甲醇蒸汽重整法。主要反应为;CH3OH(g)
 CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。
CO(g)+2H2(g)设在容积为2.0L的密闭容器中充入0. 60
molCH3OH(g),体系压强为P1,在一定条件下达到平衡时,体系压强为P2,且P2/P1
=2.2,则该条件下CH3OH 的平衡转化率为______ 。
②甲醇部分氧化法。在一定温度下以Ag/CeO2-ZnO为催化剂时原料气比例对反应的选择性(选择性越大,表示生成的该物质越多)影响关系如图所示。则当n(O2)/n(CH3OH) =0.25时。CH3OH与O2发生的主要反应方程式为______ 。在制备H2:时最好控制n(O2))/n(CH3OH)=______。

查看答案和解析>>
科目:高中化学 来源:2014届北京市高三上学期第一次月考化学试卷(解析版) 题型:填空题
据报道,一定条件下由二氧化碳和氢气合成乙醇已成为现实。
已知:①CH3CH2OH(l)+3 O2 (g)=2CO2(g)+3H2O(l) △H=-1366.8 kJ/mol
②2H2 (g)+O2 (g)=2H2O(l) △H=-571.6 kJ/mol
(1)写出由CO2 和H2 反应合成 CH3CH2OH (l) 和H2O(l)的热化学方程式 。
(2)碱性乙醇燃料电池易储存,易推广,对环境污染小,具有非常广阔的发展前景。该燃料电池中,使用铂作电极,KOH溶液做电解质溶液。通入乙醇燃气的一极为 极,该极上的电极反应式为 。
(3)用乙醇燃料电池电解400 mL 饱和食盐水装置可简单表示如下图:

该装置中发生电解反应的方程式为 ;在铁棒附近观察到的现象是 ;当阴极产生448 mL气体(体积在标准状况下测得)时,停止电解,将电解后的溶液混合均匀,溶液的pH为 。(不考虑气体的溶解及溶液体积的变化)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山东省诸城市高三2月月考(理综)化学部分 题型:填空题
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g) CH3OH(g)
CH3OH(g) 
②CO(g)+H2O(g)=CO2(g)+H2(g)

写出由二氧化碳、氢气制备甲醇的热化学方程式 ;
(2)在压强0.1MPa条件下,容积为 VL的容器中充入amolCO与2amolH2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
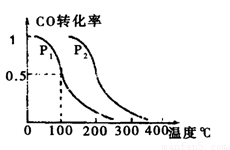
①P1 P2(填大于、小于或等于);
②在其它条件不变的情况下,再增加 amolCO与2amolH2,达到新平衡时,CO的转化率 (填“增大”、“减小”或“不变”,下 同),平衡常数 。
(3)以甲醇为燃料的新型燃料电池,正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:CH3OH+H2O-6e-=CO2+6H+
①正极的电极反应式是 ;放电时,H+移向电池的 (填“正”或“负”)极。
②若以该燃料电池作为电源,用石墨作电极电解500mL饱和食盐水,当两极共收集到标准状况下的气体1.12L(不考虑气体的溶解)时,所得溶液的pH= (假设反应前后溶液体积不变)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com