
【题目】氯气是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所学知识回答下列问题:
(1)把氯气通入紫色石蕊溶液中,可以观察到的现象是_________;
(2)氯气与水反应生成次氯酸(HClO)具有杀菌作用,常用于自来水消毒。请写出氯气与水反应的化学方程式:___________,在该反应中氧化产物是_________,还原产物是____________。
(3)某化学兴趣小组计划用氯气和氢氧化钠制取简易消毒液。其反应原理为(用化学方程式表示):_________。
(4)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用:
①该同学应称取NaOH固体__________ g;
②上述实验除了需要托盘天平、药匙、烧杯、玻璃棒、量筒等仪器外,还需要的仪器有_______。
③下列操作使配制的NaOH溶液浓度偏低的有__________。
A.将砝码放在左盘上,NaOH放在右盘上进行称量
B.定容的仰视刻度线
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
(5)取上述配制的NaOH溶液______ L才能与0.224 L 氯气(标准状况下)恰好完全反应。
【答案】先变红后褪色 Cl2+H2O=HCl+HClO HClO HCl Cl2+2NaOH=NaCl+NaClO+H2O 10.0 胶头滴管、500 mL 容量瓶 BC 0.04
【解析】
(1)氯气和水反应生成盐酸和次氯酸,溶液中含有酸,紫色石蕊试液遇酸变红色,所以溶液呈现红色,但次氯酸有漂白性,所以溶液立即褪色;故答案为:溶液先变红色后褪色;
(2)氯气与水反应生成次氯酸(HClO)具有杀菌作用,反应方程式为:Cl2+H2O=Cl-+HClO+H+,在该反应中一半0价氯被氧化成+1价,氧化产物是HClO,另一半0价氯被还原成-1价,还原产物是HCl;
故答案为:Cl2+H2O=Cl-+HClO+H+;HClO;HCl;
(3)用氯气和氢氧化钠制取简易消毒液,生成氯化钠、次氯酸钠和水,其反应原理为(用化学方程式表示):Cl2+2NaOH=NaCl+NaClO+H2O。故答案为:Cl2+2NaOH=NaCl+NaClO+H2O。
(4)某同学帮助水质检测站配制480 mL 0.5 mol·L-1NaOH溶液以备使用:
①实验室没有480mL容量瓶,需选用500mL容量瓶,配制500mL溶液,则该同学应称取NaOH固体m=cVM=0.5mol·L-1×0.5L×40g·mol-1=10.0g,故答案为:10.0;
②根据各仪器的作用选取仪器,还需要配制溶液的500mL容量瓶,用于定容的胶头滴管,故答案为:500mL容量瓶、胶头滴管;
③根据c=![]() 分析误差,
分析误差,
A.将砝码放在左盘上,NaOH放在右盘上进行称量,如不用游砝,对NaOH浓度没有影响,用游砝时,所称物体的质量偏小,使配制的NaOH溶液浓度偏低,故A不选;
B.定容的仰视刻度线,导致溶液体积偏大,配制溶液浓度偏低,故B选;
C.定容摇匀后,液面下降,又加水至刻度线,导致溶液体积偏大,配制溶液浓度偏低,故C选;
D.整个配制过程中,容量瓶不振荡,配得的溶液不均匀,故D不选;
故选BC。
(5)根据Cl2+2OH-=Cl-+ClO-+H2O得,需要氢氧化钠的体积=![]() =0.04L,故答案为:0.04;
=0.04L,故答案为:0.04;


科目:高中化学 来源: 题型:
【题目】某天然碱可以看作是CO2 和 NaOH 反应后的产物组成的一种物质。为了研究该物质的组成,进行如下实验:
ⅰ称取 3.98 g 天然碱样品,加入 50mL 稀盐酸(足量),产生 CO2 896mL(标准状况)。
ⅱ称取 3.98g 天然碱样品,加热至分解完全,产生 CO2 224mL(标准状况)和 0.36g 水。
①该稀盐酸的物质的量浓度最小是_____________。
②天然碱的化学式是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将可称量的物质与难以称量的微观粒子之间联系起来,国际上采用了“物质的量”这一物理量,据此完成下列试题:
(1)等质量的O2和O3所含分子的物质的量之比为___。
(2)等温等压下,等体积的O2和O3所含分子个数比为___,质量比为___。
(3)设NA为阿伏加德罗常数的值,如果ag氧气中含有的分子数为b,则cg氧气在标准状况下的体积约是___(用含a、b、c、NA的式子表示)。
(4)实验室需要配制100mL1mol/L的NaOH溶液,进行如下操作:
①配制该溶液所需主要仪器除了托盘天平、玻璃棒、烧杯、胶头滴管,还需要的玻璃仪器___。
②计算需要NaOH固体的质量:___g。
③取出50 mL配制好的溶液,此溶液中NaOH的物质的量浓度为___。
④若出现如下情况,导致所配溶液浓度偏高的是___。
A.称量时砝码已经生锈
B.定容时仰视
C.溶解、转移溶液之后没有对烧杯和玻璃棒进行洗涤操作
D.定容摇匀后,液面低于容量瓶颈上的刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Cu+基态核外电子排布式为__________。
(2)基态Fe原子有______个未成对电子,Fe3+的电子排布式为__________。
(3)S的基态原子核外有_____个未成对电子;Si的基态原子核外电子排布式为_______________。
(4)Cu的价层电子轨道示意图为_____。
(5)基态Si原子中,电子占据的最高能层符号为_____,该能层具有的原子轨道数为_____,电子数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构∧,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A。下列有关说法错误的是( )
A.有机物A的一氯代物只有4种
B.用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C.有机物A的分子式为C8H18
D.B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示是一套蒸馏装置,图中的错误是__________________。
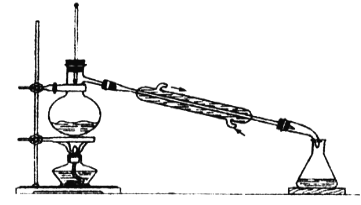
(2)若用蒸馏的方法分离甘油(沸点290℃)和水的混合物,被蒸馏出来的物质是___________,从温度计上判断该物质已被完全蒸出的现象是______________。
(3)若用蒸馏的方法分离出![]() (沸点为76.8℃)中含有的乙醚
(沸点为76.8℃)中含有的乙醚![]() (沸点为45℃),应控制温度在______________。
(沸点为45℃),应控制温度在______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用胆矾(CuSO45H2O)配制0.1mol/L的硫酸铜溶液,正确的操作是_______
A.将胆矾加热除去结晶水后,称取16g溶解在1L水中
B.称取25g胆矾溶于水,然后将此溶液稀释至1L
C.称取25g胆矾溶解在1L水里
D.将16g胆矾溶于水,然后将此溶液稀释至1L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较正确的是( )
A. 第一电离能:I1(Na)>I1(Cl) B. 原子半径:r(C)>r(N)
C. 能级能量:E(2s)>E(3s) D. 电负性:O原子>F原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com