
 .
.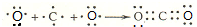 ,1molce2含有σ键的数目为6.02×1023.
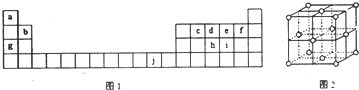
,1molce2含有σ键的数目为6.02×1023.分析 由元素在周期表中位置,可知a为H,b为Be,c为C,d为N,e为O,f为F,g为Na,h为P,i为S,j为Cu.
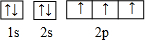
(1)F原子核外电子排布式为1s22s22p5,根据洪特规则、泡利原理画出核外电子排布图;
(2)CO2为共价化合物,用C原子、O原子电子式表示其形成,其结构式为O=C=O,双键含有1个σ键、1个π键;
(3)水分子之间形成氢键,沸点高于硫化氢的;
(4)A.j为Cu,处于第四周期IB族,为ds区元素;
B.d为N,外围电子排布为2s22p3,同周期自左而右元素电负性增大;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大;
D.h与f形成的分子为PF3,P原子形成3个σ键,含有1对孤对电子;
(5)①由j的晶胞图可知,晶胞属于面心立方密堆积;
②根据均摊法计算晶胞中Cu原子数目,再用NA表示出晶胞质量,根据m=ρV整理可得阿伏伽德罗常数表达式.
解答 解:由元素在周期表中位置,可知a为H,b为Be,c为C,d为N,e为O,f为F,g为Na,h为P,i为S,j为Cu.
(1)F原子核外电子排布式为1s22s22p5,根据洪特规则、泡利原理,核外电子排布图为 ,
,
故答案为: ;
;
(2)CO2为共价化合物,用电子式表示其形成过程: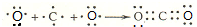 ,其结构式为O=C=O,双键含有1个σ键、1个π键,1molCO2含有σ键的数目为6.02×1023,
,其结构式为O=C=O,双键含有1个σ键、1个π键,1molCO2含有σ键的数目为6.02×1023,
故答案为: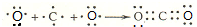 ;6.02×1023;
;6.02×1023;
(3)a与e、i形成的分子分别为H2O、H2S,H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强,故H2O的沸点高于H2S的沸点,
故答案为:H2O;H2O分子之间形成氢键,H2S分子之间为范德华力,氢键比范德华力更强;
(4)A.j为Cu,处于第四周期IB族,为ds区元素,故A正确;
B.d为N,外围电子排布为2s22p3,2p能能级半充满,属于p区元素,同周期自左而右元素电负性增大,电负性N>Be,故B正确;
C.同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径Na>O>F,故C错误;
D.h与f形成的分子为PF3,P原子形成3个σ键,含有1对孤对电子,为三角锥形结构,属于极性分子,故D错误,
故选:AB;
(5)①由j的晶胞图可知,晶胞属于面心立方密堆积,故选:C;
②晶胞中Cu原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞质量为4×$\frac{64}{{N}_{A}}$g,晶胞立方体的边长为a cm,密度为p g/cm3,则(a cm)3×p g/cm3=4×$\frac{64}{{N}_{A}}$g,故NA=$\frac{256}{p×{a}^{3}}$,故答案为:$\frac{256}{p×{a}^{3}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电子式、化学键、氢键、元素周期表与元素周期律、分子结构与性质、晶胞结构与计算等,旨在考查学生对基础知识的理解掌握,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
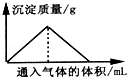
| A. | 向漂白粉溶液中通入CO2气体至过量 | |
| B. | 向Na2SiO3溶液中通入HCl气体至过量 | |
| C. | 向Ba(OH)2和KOH混合溶液中通入CO2气体至过量 | |
| D. | 向NaAlO2溶液中通入HCl气体至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸与石灰石反应CO32-+H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液Ba2++S042-═Ba+S04↓ | |
| C. | 氢氧化镁和盐酸反应:H++OH-═H2O | |
| D. | 氯化铝溶液中加人过量氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | v(Fe)=0.5mol/(L•min) | B. | v(H2SO4)=0.5mol/(L•min) | ||
| C. | v(H2)=0.5mol/(L•min) | D. | v(FeSO4)=0.5mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
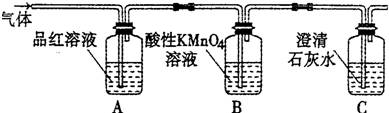
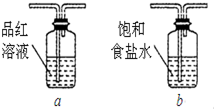
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于分子晶体 | B. | [PCl4]+空间构型为正四面体 | ||
| C. | 阴阳离子均含有配位键 | D. | 固态可导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com