
(18分)(Ⅰ)某兴趣小组的同学用下图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的指针发生了偏转。请回答下列问题:
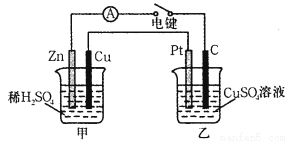
(1)甲装置的名称是_____(填“原电池”或“电解池”)。
(2)写出电极反应式:Pt极 ;
当甲中产生0.1 mol气体时,乙中析出铜的质量应为___________。
(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,乙中溶液的颜色_______(填“变深”、“变浅”或“无变化”)。
(4)若乙池溶液通电一段时间后,向所得的溶液中加入0.1mol的Cu(OH)2后恰好恢复到电解前的浓度。则电解过程中转移电子的数目为 。(用NA表示)
(Ⅱ)由Cu2+、Cl- 、Na+、SO42-四种离子中的两种离子组成的电解质溶液若干种,可选用铁电极、铜电极、铂电极进行电解实验。
(1)欲使铁制品表面镀铜,应以_______为阳极,电解质溶液为 。
(2)以铂作阳极电解 溶液时,溶液的碱性有明显增强,且溶液保澄清,电解时总反应的化学方程式为 。
Ⅰ.(1)原电池;(2)2Cl--2e-=Cl2↑ 、 6.4g;(3) 变深 ;(4) 0.4NA ;
Ⅱ.(1) 铜 、硫酸铜或氯化铜溶液 ;(2) 氯化钠溶液
【解析】
试题分析:(Ⅰ)(1)根据图中的铜、锌两种电极和电解质稀硫酸构成闭合电路知:该装置为原电池,Zn活泼,则Zn作负极,Cu作正极,发生电池反应为Zn+H2SO4═ZnSO4+H2↑,电子由负极流向正极,该装置将化学能转变为电能。(2)甲装置为原电池,将化学能转变为电能,乙装置为电解池,石墨和铂都为惰性电极,连接电源正极的铂电极为电解池的阳极,发生氧化反应:2Cl--2e-=Cl2↑,连接电源负极的碳电极为电解池的阴极,发生:Cu2++2e-=Cu,根据原电池、电解池中电子守恒,当甲中产生0.1mol气体时,铜正极上发生2H++2e-=H2↑,转移0.2mol电子,根据Cu2++2e-=Cu,乙中析出铜的物质的量为0.1mol,质量为6.4克。(3)若乙中溶液不变,将其电极都换成铜电极,电键闭合一段时间后,为电镀池,阳极铜溶解Cu-2e-=Cu2+,阴极铜上铜离子得电子析出金属铜Cu2++2e-=Cu,溶液中铜离子颜色为蓝绿色,溶液中c(Cu2+)不变,所以颜色未变。(4)1 mol Cu(OH)2可看成0.1 mol CuO·H2O即加入0.1 mol CuO和0.1 mol H2O能恢复到电解前的浓度。电解CuSO40.1 mol,转移电子0.2 mol,电解消耗水0.1 mol,又转移电子0.2 mol,共转移0.4 mol e-;(Ⅱ)由Cu2+、Cl-、Na+、SO42-四种离子中的两种离子组成的电解质溶液,可以是CuCl2、Na2SO4;也可为CuSO4、NaCl;(1)铁制品表面镀铜,应铜做阳极,电解硫酸铜或氯化铜溶液;(2)以铂作阳极电解硫酸铜,电解过程中,阳极:溶液中阴离子OH-、SO42-移向阳极,氢氧根离子放电发生氧化反应,电极反应式:4OH--4e-═2H2O+O2↑;阴极:溶液中阳离子Cu2+、H+移向阴极发生还原反应,电极反应:2Cu2++4e-═2Cu;所以溶液中氢氧离子浓度逐渐减小,氢离子浓度逐渐增大,pH值逐渐变小;以铂作阳极电解氯化钠溶液时,阴极电极反应式为:2H2O+2e-=H2 ↑+2OH-,阳极上氯离子失电子发生氧化反应,电极反应式为:2Cl--2e-=Cl2↑,同时生成氢氧化钠,所以其电池反应式为:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,且溶液保持澄清;
2NaOH+H2↑+Cl2↑,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,且溶液保持澄清;
考点:考查电解原理、化学电源新型电池。


科目:高中化学 来源:2014-2015学年安徽省高二上学期期中化学试卷(解析版) 题型:选择题
2-氯丙烷跟氢氧化钠的醇溶液共热后,生成的产物再与溴水反应,得到的产物的同分异构
体有
A.2种 B.4种 C.3种 D.5种
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高一上学期期末化学试卷(解析版) 题型:计算题
(6分)将100 mL 5 mol·L-1 NaOH(aq)稀释到500 mL,稀释后溶液中NaOH的物质的量浓度为______________;将氯气通入此溶液充分反应,可制得漂白液,其中含有效成分的物质的量最多为_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高一上学期期末化学试卷(解析版) 题型:选择题
下列离子方程式的书写正确的是
A.铁和稀硫酸反应:2Fe + 6H+ =2Fe 3+ +3H 2↑
B.NaHCO3溶液与NaOH溶液反应: OH― + HCO3― = CO32― + H2O
C.钠和冷水反应 Na+2H2O=Na++2OH?+H2↑
D.氯化铝溶液中加入过量的氨水 Al3+ + 4NH3·H2O =AlO2- + 4NH4++ 2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高一上学期期末化学试卷(解析版) 题型:选择题
下列情况会对人体健康造成较大危害的是
A.自来水中通入少量Cl2进行消毒杀菌
B.用SO2漂白食品
C.用食醋清洗热水瓶胆内壁附着的水垢
D.用小苏打发酵面团制作馒头
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高二上学期期末化学试卷(解析版) 题型:选择题
高温下,某反应达平衡,平衡常数 ,恒容时,温度升高,H2浓度减小。下列说法正确的是
,恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应化学方程式为CO + H2O CO2 + H2
CO2 + H2
查看答案和解析>>
科目:高中化学 来源:2014-2015甘肃省白银市高二上学期期末化学试卷(解析版) 题型:选择题
下列各组离子在指定环境中一定能大量共存的是
A.在碳酸氢钠溶液中: K+、Al3+、SO42-、Cl-
B.存在较多Fe3+的溶液中:Na+、SCN-、CO32-、K+
C.常温下由水电离出的C(H+)水·C(OH-)水 = 10-24 溶液中:NH4+、Cl-、CO32-、F-
D.在能使红色石蕊试纸变蓝色的溶液中:Na+ 、S2- 、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省高三上学期第三次月考化学试卷(解析版) 题型:选择题
某CuSO4、Fe2(SO4)3、H2SO4的混合溶液100mL,已知溶液中阳离子的浓度相同(不考虑水解),且SO42-的物质的量浓度为6mol·L-1,则此溶液最多溶解铁粉的质量为
A.5.6 g B.11.2g C.22.4g D.33.6g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河北省邯郸市高三上学期1月教学质量检测化学试卷(解析版) 题型:选择题
在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+和Fe2+的物质的量之比为3∶2∶1,现加入适量铁粉,使溶液中三种离子物质的量浓度之比变化为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为
A.2∶1 B.1∶2 C.1∶3 D.1∶4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com